Oscar Kurt Bitzer Quintero. Instituto Mexicano del Seguro Social, Centro de Investigación Biomédica de Occidente, División de Neurociencias, Guadalajara, Jalisco, México.
e-mail: neuronim26@yahoo.com
ORCID: https://orcid.org/0000-0002-9754-1430
Sandra Luz Ruiz Quezada. Laboratorio de Biología Molecular. Departamento de Farmacobiología. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Jalisco, México.
e-mail: sandra.ruiz@academicos.udg.mx
ORCID: https://orcid.org/0000-0002-3895-5123
María Teresa Romero Gutiérrez. Departamento de Innovación Tecnológica, Centro Universitario de Tlajomulco, Tlajomulco de Zúñiga, Jalisco, México.
e-mail: maria.romero@academicos.udg.mx
ORCID: https://orcid.org/0000-0002-4882-7491
Valeria Desiré Bella Tapia. Centro Universitario de Ciencias Exactas e ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México. e-mail: valeria.bella0924@alumnos.udg.mx
Adriana Patricia Mendizabal Ruiz *. Laboratorio de Análisis Clínicos e Investigación Traslacional. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: partricia.mendizabal@academicos.udg.mx ORCID: https://orcid.org/0000-0001-7553-6350
Cite este artículo así:
APA: Bitzer-Quintero, O. Ruiz-Quezada, S. Romero-Gutiérrez, M. Bella-Tapia, V. Mendizabal-Ruiz, A*. (2025). De la neuroquímica a la microbiota: una nueva perspectiva sobre la esquizofrenia. Quimiofilia, 2025, 4, (2), 32-36.
MDPI y JACS: Bitzer-Quintero, O.; Ruiz-Quezada, S.; Romero-Gutiérrez, M.; Bella-Tapia, V.; Mendizabal-Ruiz, A*. Quimiofilia, 2025, 4, 2, 32-36.
DOI: https://doi.org/10.56604/qflaSC2025423236
Recibido:13 de septiembre 2025. Aceptado: 22 de octubre 2025. Publicado. 7 de diciembre de 2025.
www.quimiofilia.com. ISSN: 2683-2364. Registro IMPI: 2052060 QUIMIOFILIA.Reserva de derechos al uso exclusivo 2022: 04-2019-062013201300-203.
Resumen
La esquizofrenia es un trastorno mental crónico y debilitante que afecta el pensamiento, las emociones y el comportamiento. Durante décadas, la investigación de sus causas se ha centrado en complejos desequilibrios neuroquímicos en el cerebro, particularmente aquellos que involucran a la dopamina y el glutamato. Si bien estas hipótesis han explicado parte de la enfermedad, dejan muchas preguntas sin respuesta: ¿Por qué algunos pacientes responden de manera diferente a los medicamentos? ¿Por qué varían tanto los síntomas?
Ante estas limitaciones, la investigación se ha ampliado para considerar aspectos que van más allá del cerebro prestando atención a una conexión que hasta hace poco era inconcebible: el vasto ecosistema de microorganismos que vive en nuestros intestinos, conocido como microbiota. Este ecosistema no solo participa en la digestión y protección contra patógenos, sino que también produce moléculas que se comunican con el cerebro.
Este artículo explora esta nueva frontera de la neurociencia. En él, se examina cómo la comunicación bidireccional a través del eje microbiota-intestino-cerebro influye en los neurotransmisores, la inflamación y la salud neuronal, ofreciendo nuevas claves para la comprensión y el desarrollo de futuros tratamientos para la esquizofrenia.
Palabras clave
microbiota; esquizofrenia; neuroquímica; dopamina, glutamato.
Introducción
Esquizofrenia: la complejidad de un trastorno cerebral
La esquizofrenia es un trastorno neuropsiquiátrico crónico y heterogéneo, se manifiesta a través de un conjunto de síntomas que afectan de manera severa el pensamiento, las emociones y el comportamiento.1,2 Su cuadro clínico incluye delirios (creencias firmes pero alejadas de la realidad), alucinaciones (percepción de cosas que no están ahí), un lenguaje confuso y conductas desorganizadas.3 Estos síntomas a menudo conducen al deterioro significativo del razonamiento y la resolución de problemas, lo que resulta en una disfunción social importante.4 Dada su prevalencia y las repercusiones sobre la salud, el bienestar y la economía, la esquizofrenia representa un problema de salud pública de gran relevancia mundial.5 A pesar de los avances científicos, no existe una causa única claramente identificada, sino que se considera el resultado de una compleja combinación de factores biológicos, genéticos y ambientales.6
La dopamina y el glutamato: un delicado desequilibrio neuroquímico
La dopamina es un neurotransmisor que desempeña un papel esencial en múltiples procesos fisiológicos como la emoción, la memoria, la atención y el sistema de recompensa. Desde finales de la década de 1950, ha sido un componente central en las terapias sobre la esquizofrenia. La hipótesis dopaminérgica sugiere que los síntomas de esta enfermedad están relacionados con los desequilibrios en sus niveles.7
Un desequilibrio de dopamina incluye un aumento de su actividad en vías que conectan áreas importantes que regulan procesos de motivación y el sistema de recompensas del cerebro, lo que se ha asociado con déficits en la memoria y el aprendizaje, además de alucinaciones y delirios en algunos pacientes. Por un lado, la hiperactividad de los receptores dopaminérgicos D2 en regiones cerebrales como la vía mesolímbica se asocia con síntomas como las alucinaciones y los delirios.8 Por otro lado, los niveles bajos de dopamina en la vía mesocortical (en la corteza prefrontal), se relacionan con los síntomas como el deterioro cognitivo, emocional y del comportamiento, que se manifiestan como apatía, dificultad para mostrar emociones o retraimiento social.9 Esta dualidad resalta la importancia de la dopamina en el equilibrio cerebral y su relación con los complejos síntomas de la esquizofrenia.
Sin embargo, investigaciones recientes han revelado que la esquizofrenia no puede explicarse únicamente por esta hipótesis. La hipótesis glutamatérgica, formulada tras el hallazgo de niveles reducidos de glutamato (el principal neurotransmisor excitatorio del cerebro) en pacientes con esquizofrenia, postula que una hipofunción del receptor NMDA (N-metil-D-aspartato), que es un tipo de receptor de glutamato, también tiene un papel importante. Actualmente, se considera que las teorías más completas combinan ambos conceptos: una sobreactivación del sistema dopaminérgico y una hipofunción del sistema glutamatérgico.10 No obstante, ninguna de estas teorías explica completamente la variedad de síntomas ni la respuesta diversa al tratamiento que se observa en los pacientes. Ante estas limitaciones, la investigación se ha ampliado para abarcar factores más allá del cerebro. Dirigiendo la atención hacia la microbiota —la comunidad de microorganismos que habita nuestro cuerpo— que podría ofrecer nuevas claves para una mejor comprensión de la esquizofrenia.11
El eje microbiota-intestino-cerebro: una red de comunicación bidireccional
El tracto gastrointestinal es el huésped de billones de microorganismos comensales, que cumplen un papel clave en el mantenimiento de la inmunidad del hospedero y están íntimamente relacionados con los mecanismos de homeostasis. La homeostasis es la capacidad del ecosistema intestinal de mantener la diversidad microbiana y las funciones que desempeñan, incluso frente a los cambios que ocurren en el organismo y su entorno. La colección de bacterias, arqueas y eucariotas (principalmente hongos y protozoos unicelulares) se conoce como microbiota.1 Estas bacterias, especialmente las familias Bacteroidetes y Firmicutes, que constituyen aproximadamente el 90 % de la población total, mantienen una importante relación simbiótica con el hospedador, participando en procesos de inmunidad, metabolismo de nutrientes y medicamentos, así como en la protección contra patógenos.1,2
Más allá del intestino, esta comunidad microbiana influye en el cerebro a través de una estrecha y compleja comunicación bidireccional conocida como el eje Microbiota-Intestino-Cerebro (eje-MIC).1,12,7 Los microorganismos intestinales actúan sobre el sistema nervioso entérico liberando neurotransmisores como dopamina, serotonina y noradrenalina, o a través del paso de metabolitos o endotoxinas a la circulación.9 El nervio vago es el principal mediador de esta comunicación, siendo fundamental para trasmitir información hacia el sistema nervioso central. Además, es clave en la influencia de la dopamina a nivel central y periférico, dado que su estimulación induce la activación dopaminérgica y afecta directamente los niveles cerebrales de este neurotransmisor.13,14
Evidencia de alteraciones de la microbiota en la esquizofrenia
La alteración o desequilibrio de la microbiota, conocida como disbiosis, se asocia con diversos desórdenes del sistema nervioso, como la enfermedad de Parkinson, el Alzheimer, la depresión, la ansiedad, el autismo y la esquizofrenia.8 En el caso de la esquizofrenia, los pacientes suelen presentar una mayor permeabilidad intestinal, un fenómeno conocido como “intestino permeable”.15 Esta condición se produce cuando las uniones entre las células que recubren el intestino se debilitan, permitiendo que sustancias del lumen intestinal, como los lipopolisacáridos (LPS) (moléculas presentes en la membrana de ciertas bacterias con potencial inflamatorio) entren al torrente sanguíneo. El sistema inmunitario reconoce estos compuestos como una amenaza, lo que desencadena la liberación de citocinas proinflamatorias (como la IL-6 y la IL-17). La presencia de estas citocinas inflamatorias altera la neurotransmisión dopaminérgica, lo que provoca un aumento en la síntesis y liberación de dopamina, y, consecuentemente, contribuye a algunos de los síntomas de la esquizofrenia.11
El intestino como modulador de la neuroquímica: el rol de la microbiota en las vías dopaminérgicas
La microbiota intestinal influye en las vías glutamatérgica y dopaminérgica de manera indirecta al modular el metabolismo del triptófano a través de la vía de la quinurenina. El triptófano es un precursor de la serotonina. Cuando hay disbiosis o inflamación sistémica, la vía de la quinurenina se altera, lo que interfiere con la regulación de la vía glutamatérgica. Como se mencionó anteriormente, un sistema glutamatérgico disfuncional puede provocar la pérdida del “freno” de la dopamina, lo que resulta en su liberación excesiva, un fenómeno relacionado con los síntomas de la esquizofrenia.16
Otro mecanismo clave reside en la producción de ácidos grasos de cadena corta (Short-Chain Fatty Acids, SCFA). La microbiota intestinal genera SCFA como el butirato a partir de la fermentación de carbohidratos complejos no digeribles. El butirato actúa como fuente de energía para las células del colon y modula la concentración de neurotransmisores al inhibir la enzima histona desacetilasa (Histone Deacetylase,HDAC). Es importante entender que la HDAC es una enzima que controla la expresión de genes; al inhibirla, el butirato influye en la lectura y activación de ciertos genes neuronales y consecuentemente, reduce los niveles de estrés oxidativo en el cerebro. Este efecto es crucial porque el estrés oxidativo y la HDAC están intrínsecamente ligados a la disfunción de las vías dopaminérgicas en la esquizofrenia. Adicionalmente, el butirato tiene efectos antiinflamatorios y ayuda a preservar el tejido cerebral al fortalecer la barrera hematoencefálica (BHE). La BHE funciona como un filtro altamente selectivo que protege al cerebro de sustancias dañinas transportadas por la sangre.1,17,18,19
El desequilibrio de la microbiota también puede disminuir los factores neurotróficos como el factor nervioso derivado de cerebro (Brain-Derived Neutrophic-Factor, BDNF) y el factor neurotrófico derivado de la línea celular glial (Glial Cell Line-Derived Neutrophic Factor,GDNF). Estos factores son importantes para la supervivencia y el buen funcionamiento de las neuronas. Niveles bajos de BDNF y GDNF implican una menor protección para las neuronas productoras de dopamina y una alteración en la regulación de su producción y liberación. Esta reducción de soporte es lo que se es lo que se asocia a la deficiencia de dopamina. En resumen, los diversos mecanismos modulados por la microbiota contribuyen a los complejos desequilibrios de dopamina (tanto el exceso como la deficiencia) que son característicos de la esquizofrenia.1,11,20
Un modelo integrado: de la microbiota al tratamiento
Los mecanismos descritos representan vías plausibles por las cuales la microbiota intestinal contribuye a la desregulación dopaminérgica y a la neuroinflamación observadas en la esquizofrenia. Estos hallazgos propician la generación de nuevas ideas en el ámbito terapéutico. En modelos animales, la modulación de la microbiota con probióticos de los géneros Lactobacillus y Bifidobacterium, puede aumentar la producción de SCFA, los cuales regulan directamente la expresión de BDNF en áreas cerebrales afectadas en la esquizofrenia. Esta intervención ayuda a atenuar la pérdida de neuronas dopaminérgicas.1,11
Estos descubrimientos sugieren que las intervenciones dietéticas, los probióticos o los prebióticos podrían ser estrategias complementarias para el tratamiento de la esquizofrenia, ya que su objetivo es restaurar el equilibrio de la microbiota intestinal. Sin embargo, se requiere más investigación para comprender cómo estas intervenciones pueden aplicarse en humanos y cómo pueden influir en el complejo ecosistema de nuestro “segundo cerebro”, el intestino.
Conclusiones
La investigación sobre la esquizofrenia se expande más allá de las fronteras del cerebro para considerar la influencia de la microbiota intestinal. Comprender este nuevo vinculo no solo nos acerca a una visión más completa del trastorno, sino que también permite el desarrollo de nuevas estrategias terapéuticas.
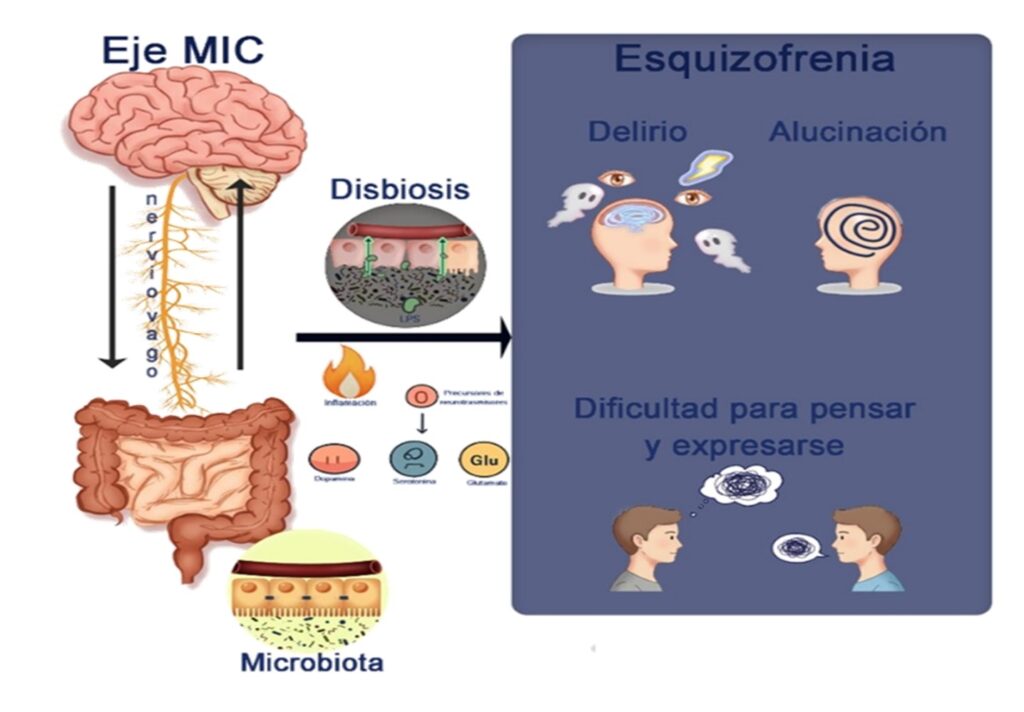
Figura 1. El eje Microbiota Intestino-Cerebro en la esquizofrenia. La disbiosis altera la comunicación intestino-cerebro (mediada por el nervio vago) y contribuye a la enfermedad por medio de varios mecanismos. Por un lado, al generar un “intestino permeable” que promueve la inflamación (vía LPS). Por el otro, al modular neurotransmisores clave como la dopamina, serotonina y glutamato. Estos mecanismos se asocian con los síntomas de la esquizofrenia.
Descargue aquí el artículo en PDF
- Hamamah, S.; Aghazarian, A.; Nazaryan, A.; Hajnal, A.; Covasa, M. Role of Microbiota-Gut-Brain Axis in Regulating Dopaminergic Signaling. Biomedicines 2022, 10 (2), 436. DOI: https://doi.org/10.3390/biomedicines10020436 ↩︎
- Eckburg, P. B.; Bik, E. M.; Bernstein, C. N.; Purdom, E.; Dethlefsen, L.; Sargent, M.; Gill, S. R.; Nelson, K. E.; Relman, D. A. Diversity of the Human Intestinal Microbial Flora. Science 2005, 308 (5728), 1635–1638. DOI: 10.1126/science.1110591 ↩︎
- American Psychiatric Association. Manual diagnóstico y estadístico de los trastornos mentales; 5th ed., text rev. (DSM-5-TR); Editorial Médica Panamericana, 2022. DOI: 10.1192/j.eurpsy.2024.1765 ↩︎
- Ooi, C. Y.; Syed, S. A.; Rossi, L.; Garg, M.; Needham, B.; Avolio, J.; Young, K.; Surette, M. G.; Gonska, T. Impact of CFTR modulation with Ivacaftor on Gut Microbiota and Intestinal Inflammation. Scientific Reports 2018, 8 (1), 17834. DOI: https://doi.org/10.1038/s41598-018-36364-6 ↩︎
- Dao, M. C.; Everard, A.; Aron-Wisnewsky, J.; Sokolovska, N.; Prifti, E.; Verger, E. O.; Kayser, B. D.; Levenez, F.; Chilloux, J.; Hoyles, L.; Dumas, M.-E.; Rizkalla, S. W.; Doré, J.; Cani, P. D.; Clément, K. Akkermansia muciniphila and improved metabolic health during a dietary intervention in obesity: relationship with gut microbiome richness and ecology. Gut 2016, 65 (3), 426–436. DOI: https://gut.bmj.com/content/65/3/426 ↩︎
- Topping, D. L.; Clifton, P. M. Short-Chain Fatty Acids and Human Colonic Function: Roles of Resistant Starch and Nonstarch Polysaccharides. Physiological Reviews 2001, 81 (3), 1031–1064. DOI: https://doi.org/10.1152/physrev.2001.81.3.1031 ↩︎
- Rhee, S. H.; Pothoulakis, C.; Mayer, E. A. Principles and clinical implications of the brain–gut–enteric microbiota axis. Nat. Rev. Gastroenterol. Hepatol. 2009, 6 (5), 306–314. DOI: 10.1038/nrgastro.2009.35. ↩︎
- Weiss, G. A.; Hennet, T. Mechanisms and consequences of intestinal dysbiosis. Cell. Mol. Life Sci. 2017, 74 (16), 2959–2977. DOI: 10.1007/s00018-017-2509-x ↩︎
- Borre, Y. E.; O’Keeffe, G. W.; Clarke, G.; Stanton, C.; Dinan, T. G.; Cryan, J. F. Microbiota and neurodevelopmental windows: implications for brain disorders. Trends Mol. Med. 2014, 20 (9), 509–518. DOI: 10.1016/j.molmed.2014.05.002. ↩︎
- Rodriguez-Vega, J. L.; Urquiza Zavaleta, R.; Navarro-Lópeez, N. A. Neurotransmisores implicados en la fisiopatología de la esquizofrenia. Revista del Hospital Psiquiátrico de La Habana 2024, 21 (2), 1–16. ↩︎
- Munawar, N.; Ahsan, K.; Muhammad, K.; Ahmad, A.; Anwar, M. A.; Shah, I.; Al Ameri, A. K.; Al Mughairbi, F. Hidden Role of Gut Microbiome Dysbiosis in Schizophrenia: Antipsychotics or Psychobiotics as Therapeutics? Int. J. Mol. Sci. 2021, 22 (14), 7671. DOI: 10.3390/ijms22147671 ↩︎
- Collins, S. M.; Bercik, P. The Relationship Between Intestinal Microbiota and the Central Nervous System in Normal Gastrointestinal Function and Disease. Gastroenterology 2009, 136 (6), 2003–2014. DOI: 10.1053/j.gastro.2009.01.075 ↩︎
- Breit, S.; Kupferberg, A.; Rogler, G.; Hasler, G. Vagus Nerve as Modulator of the Brain–Gut Axis in Psychiatric and Inflammatory Disorders. Front. Psychiatry 2018, 9, 44. DOI: https://doi.org/10.3389/fpsyt.2018.00044 ↩︎
- Dicks, L. M. T. Gut Bacteria and Neurotransmitters. Microorganisms 2022, 10 (9), 1838. DOI: 10.3390/microorganisms10091838. ↩︎
- González-Blanco, L.; Dal Santo, F.; García-Portilla, M. P.; Alfonso, M.; Hernández, C.; Sánchez-Autet, M.; Anmella, G.; Amoretti, S.; Safont, G.; Martín-Hernández, D.; Malan-Müller, S.; Bernardo, M.; Arranz, B. Intestinal permeability biomarkers in patients with schizophrenia: Additional support for the impact of lifestyle habits. Eur. Psychiatry 2024, 67 (1), e84. DOI: https://doi.org/10.1016/j.bbr.2015.05.052 ↩︎
- Więdłocha, M.; Marcinowicz, P.; Janoska-Jaździk, M.; Szulc, A. Gut microbiota, kynurenine pathway and mental disorders – Review. Prog. Neuro-Psychopharmacol. Biol. Psychiatry 2021, 106, 110145. DOI: 10.1016/j.pnpbp.2020.110145. ↩︎
- Sharma, S.; Taliyan, R.; Singh, S. Beneficial effects of sodium butyrate in 6-OHDA induced neurotoxicity and behavioral abnormalities: Modulation of histone deacetylase activity. Behav. Brain Res. 2015, 291, 306–314. DOI: 10.1016/j.bbr.2015.05.052. ↩︎
- McGuinness, A. J.; Davis, J. A.; Dawson, S. L.; Loughman, A.; Collier, F.; O’Hely, M.; Simpson, C. A.; Green, J.; Marx, W.; Hair, C.; Guest, G.; Mohebbi, M.; Berk, M.; Stupart, D.; Watters, D.; Jacka, F. N. A systematic review of gut microbiota composition in observational studies of major depressive disorder, bipolar disorder and schizophrenia. Mol. Psychiatry 2022, 27 (4), 1920–1935. DOI: 10.1038/s41380-022-01456-3. ↩︎
- Li, X.; Fan, X.; Yuan, X.; Pang, L.; Hu, S.; Wang, Y.; Huang, X.; Song, X. The Role of Butyric Acid in Treatment Response in Drug-Naïve First Episode Schizophrenia. Front. Psychiatry 2021, 12, 724664. DOI: 10.3389/fpsyt.2021.724664. ↩︎
- Fock, E.; Parnova, R. Mechanisms of Blood–Brain Barrier Protection by Microbiota-Derived Short-Chain Fatty Acids. Cells 2023, 12 (4), 657. DOI: 10.33 https://doi.org/10.3390/cells12040657 ↩︎
