
Irving David Pérez Landa. Laboratorio de Micro y Nano Tecnologías (LAMINAT). Tecnológico Nacional de México/Instituto Tecnológico de Boca del Río. Veracruz, México; e-mail: irvingperez@bdelrio.tecnm.mx. ORCID: 0000-0002-5240-5371. SCOPUS: 57219096524. Doctor en Ciencias con enfoque en Agronanotecnología y Nanotecnología Ambiental. Profesor-Investigador del Instituto Tecnológico de Boca del Río, Veracruz. Es Investigador Nacional Nivel C (SNII Nivel Candidato), miembro activo del Padrón Veracruzano de Investigadores y de la Sociedad Multidisciplinaria en Ciencias Agronómicas Aplicadas y Biotecnología.
Tonya Ivette Delgado Silva. Laboratorio de Micro y Nano Tecnologías (LAMINAT). Tecnológico Nacional de México/Insti tuto Tecnológico de Boca del Río. Veracruz, México.
José Arturo Olguín Rojas. Ingeniería en Procesos Bioalimentarios, Universidad Tecnológica de Tecamachalco. Puebla, México; e-mail: j.a.olguin.rojas@personal.uttecam.edu.mx ORCID 0000-0001-5280-1043. SCOPUS: 57207989971.
Itzel Galaviz Villa. Laboratorio de Ecotecnologías (LECO). Tecnológico Nacional de México/Instituto Tecnológico de Boca del Río. Veracruz, México; e-mail: itzelgalaviz@bdelrio.tecnm.mx ORCID: 0000-0002-8404-1365 SCOPUS: 55177179700.
Reflexión rápida
“¿Qué tan valiosas pueden ser las propiedades de una planta para considerarla ‘de oro’?”
Curso de 2 minutos
Alcamidas: Hormonas de plantas con funciones fisiológicas y adaptativas: desde la germinación hasta respuesta a patógenos. Almácigo: Espacio para sembrar especies que requieren cuidados para luego llevarlas a un lugar definitivo. Antinociceptivo: Que revierte o altera los aspectos sensoriales de la intensidad del dolor. Especie endémica: organismo confinado a una región por sus condiciones geológicas, geográficas y ecológicas: desde un lugar específico hasta un continente entero. Fascículo: En biología: conjunto de hojas, flores o manojos de raíces que crecen desde un punto. Peciolo: Rabillo que une la lámina de una hoja a su base foliar o al tallo. Pedúnculo: En botánica, es una rama que permite el sostén del fruto, la flor o la hoja. Planta perenne: Que vive durante más de dos años. Proangiogénico: Proceso fisiológico de formación de vasos sanguíneos nuevos. Receptáculo: En botánica, el lugar donde se insertan las piezas florales y en muchas plantas interviene en la constitución del fruto.
Mini biografía
Elbert Luther Little, (1907-2004). El chilcuague (Heliopsis longipes) planta insecticida.
Cite este artículo así: APA: Pérez-Landa, I.* Delgado-Silva, T. Olguín-Rojas J. Galaviz-Villa (2024). Heliopsis longipes S.F. Blake., una Planta Indígena con “Raíces de Oro”: Genera lidades y Potencial Biotecnológico. Quimiofilia, 2024, 3,(2), 22-25 MDPI y JACS: Pérez-Landa, I.*; Delgado-Silva, T.; Olguín-Rojas J.; Galaviz Villa Quimiofilia, 2024, 3, 2, 22-25 DOI: https://doi.org/10.56604/qfla2024322225
Recibido:13 de mayo 2024. Aceptado: 06 de diciembre 2024. Publicado: 10 de diciembre de 2024.
www.quimiofilia.com ISSN: 2683-2364. Registro IMPI: 2052060 QUIMIOFILIA. Reserva de dere chos al uso exclusivo 2022: 04-2019-062013201300-203
Resumen
En esta obra se presenta información sobre el chilcuague (Heliop sis longipes S.F. Blake), una planta endémica del centro de México con atributos que le confieren gran importancia cultural, biológica y económica. Esta lectura brinda un resumen sobre su taxonomía, morfología, distribución geográfica, cultivo, vulnerabilidad, usos tradicionales, composición química y propiedades, así como su potencial biotecnológico.
Palabras Clave
Afinina, alcamidas, biocida, extractos vegetales, Heliopsis.
Introducción
Heliopsis longipes (A. Gray) S.F. Blake (Asteraceae) (en adelante H. longipes) es una especie vegetal perenne comúnmente conocida como chilcuague, chilcuán o chilcuas, aunque también tiene otras denominaciones de origen náhuatl, tales como chilcoatl, ichcha, chilcuán (chile de víbora), chilmécatl (chili: chile y mécatl: mecate) y chilicau, los cuales hacen alusión al sabor de su raíz parecido al del chile; y otras provenientes de la era de la colo nia, como pelitre y peritre. Actualmente también tiene otros nombres comerciales como raíz de oro y raíz azteca.1 La distribución del género Heliopsis2 se restringe al hemisferio occidental, existiendo diez especies en México y ocho de ellas, incluyendo a H. longipes, son endémicas. Particularmente, H. longipes se distribuye en la Sierra Álvarez y la Sierra Gorda, donde coinciden áreas pertenecientes a los estados de Guanajuato, Querétaro y San Luis Potosí.3 La Tabla 1 muestra su clasificación científica. H: longipes es una planta de raíces fibrosas que por lo general se presentan en fascículos o a veces solitarias, con una longitud de 15 a 30 cm y un diámetro que oscila entre tres y cuatro mm. Estas raíces no tienen ramificaciones, sino algunas fibras lateras extendidas en la tierra. Sus tallos son herbáceos y leñosos en la base, la cual alcanza una altura entre los 20 y 50 cm. Sus hojas son opuestas y ovadas, con longitudes de dos a cuatro cm de largo, las cuales son dentadas o aserradas y poseen peciolos cortos. También posee pedúnculos de flores alargados de 10 a 25 cm (de ahí proviene el nombre de la especie “longipes”). Sus flores son amarillas, teniendo aproximadamente 10 liguladas que van de los 15 a 18 mm de largo y 6 de ancho; y también tubulosas las cuales son cuadrangulares y con pocos nervios con dos o cuatro dientes me nudos. Las escamas del receptáculo miden 6 o 7 mm de largo más que las flores tubulosas y son amarillas o anaranjadas en la punta (Figura 1).
Tabla 1. Clasificación científica de Heliopsis longipes.
| Clasificación | Denominación |
| Reino | Plantae |
| Subreino | Tracheobionta |
| División | Magnoliophyta |
| Clase | Magnolipsida |
| Orden | Asterales |
| Familia | Asteraceae |
| Tribu | Heliantheae |
| Género | Heliopsis |
| Especie | Heliopsis longipes |
Fuente: Adaptado de 2.

Figura 1. Imágenes de H. longipes: (a) Planta completa; (b) Flores liguladas (periferia) y tubulosas (al centro);4 (c) Raíces.
Las hojas y tallos de H. longipes experimentan un crecimiento acelerado entre junio y septiembre, con un período de floración que se extiende de julio a septiembre. Esta especie se desarrolla en suelos de textura media, cubiertos por una capa de materia orgá nica, sobre sustratos geológicos de origen ígneo. Principalmente, su distribución se limita a cañones pronunciados de bosques de encino y pino-encino con altitudes promedio de 1695.5 m, en climas templados subhúmedos.3 La propagación masiva de H. longipes ha presentado desafíos, particularmente en la etapa de tras plante de las plántulas. Si este trasplante se retarda una semana pocas plantas sobreviven ya que sus raíces son delicadas y se secan al exponerlas al aire. Su trasplante ha sido exitoso en lugares con alturas de 1800 a 2400 metros sobre el nivel del mar, haciéndolo en filas y almácigos o semilleros.5 H. longipes es una especie cuya raíz ha sido tradicionalmente utilizada como condimento para los frijoles y otros alimentos, ya que su sabor es similar al del chile y estimula la secreción de sa liva. Adicionalmente, también puede macerarse en bebidas al cohólicas para darles cierta fuerza. Su consumo elevado puede causar sofocación y como muchas otras sustancias, conducir a la muerte.5 Su uso como medicamento en la herbolaria indígena se atribuye a la sensación de adormecimiento en músculos, así como en la boca y lengua luego de masticarla. Los dentistas han utiliza dos extractos alcohólicos de la raíz como anestésico. Como desparasitante, suele masticarse en ayunas un trozo de raíz, o agregarse en los alimentos. Además, se ha documentado que el uso de una tintura alcohólica brinda buenos resultados contra resfriados y la pulmonía.6
La planta H. longipes produce una mezcla compleja de clorofilas y poliaminas antioxidantes, así como varios posibles antimutáge nos. A la fecha, se han identificado en sus raíces, hojas y flores diversos taninos, compuestos fenólicos, flavonoides, esteroles, tri terpenos y alcaloides (particularmente N-alcamidas). Las alcami das han sido encontradas en diversas plantas, siendo la familia del chilcuague (asteráceas) una de las tres familias con el mayor con tenido de estas, junto con la familia de la pimienta negra (piperá ceas) y la ruda (rutáceas).7 La alcamida afinina se ha posicionado como su compuesto ac tivo de mayor presencia e importancia.8, 9,10 Estudios recientes han evaluado el efecto del extracto de H. longipes y de la afinina contra el dolor,11 así como su actividad proangiogénica, antinoniceptiva, antiartrítica, antiviral, antiulcerosa, antiinflamatoria9,12 y estimu lante sobre el sistema nervioso central, encontrando que tanto la afinina purificada como el extracto etanólico obtenido de sus raí ces tienen acción analgésica similar al ketorolaco y un efecto esti mulante similar al de la cafeína en ratones adultos.13 La afinina obtenida del extracto etanólico de la raíz de H. longipes también ha mostrado resultados promisorios como agente antimutagénico y posible anticancerígeno.14
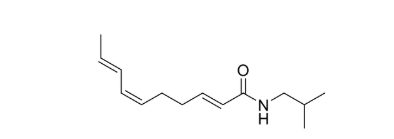
Figura 2. Estructura química de la alcamida afinina (N-isobutil 2E,6Z,8E-decatrienamida).
El descubrimiento de la actividad biocida de la raíz de H. longi pes se remonta a los tiempos de la segunda guerra mundial.5 Se ha reportado que algunos parásitos de la piel del ganado mueren con la raíz molida aplicada en la lesión. En los últimos años diversos estudios han demostrado que el extracto de raíz de H. longipes y la afinina obtenida de estas poseen propiedades insecticidas. Entre los resultados exitosos puede destacarse la evaluación de su acción paralítica y tóxica contra las moscas domésticas y otros insectos como el gorgojo del frijol (Acanthoseelides octectus Say) y los mosquitos vectores de la malaria y el dengue (Anopheles albima nus y Aedes aegypti), incluyendo a sus larvas.6,15 La alcamida afinina (C14H23NO) ha mostrado inhibición del crecimiento celular de E. coli, S. cerevisiae, P. solanacearum y B. subtilis, lo que da sustento a su actividad antimicrobiana y bactericida.16,17 17 Los extractos de H. longipes, y particularmente la afinina, han mostrado una notable actividad fungicida contra una amplia gama de hongos fitopatógenos, entre ellos podemos mencionar a Asper gillus parasiticus y Aspergillus flavus, hongos productores de afla toxinas ampliamente diseminados en la naturaleza, los cuales pueden contaminar a diversos productos agrícolas,18,19 así como también Rhizoctonia solani, Colletotrichum lindemuthianum, Co lletotrichum gloeosporioides, Phytophthora cinnamoni, Phytop hthora infestans, Sclerotium rolfsii, Sclerotium cepivorum, Verti cillium sp. y Fusarium sp., responsables de enfermedades que po nen en riesgo a los cultivos de frijol, mango, aguacate, papa, to mate, cebolla y ajo, por mencionar algunos; y también ha mostrado efecto inhibitorio contra hongos patógenos para humanos y animales, como Candida albicans, Sporothrix schenckii y Mucor circinelloides20,21 y contra algunos moluscos asociados a la esquis tosomiasis.9 Adicional a toda la evidencia existente sobre su efecto biocida, también se ha probado que la afinina y sus derivados tie nen un efecto benéfico sobre el crecimiento de plantas de Arabi dopsis thaliana y el desarrollo temprano de sus raíces.7 La Figura 3 muestra un resumen de los usos y propiedades de H. longipes.
Conclusiones
En H. longipes se encuentran presentes diversos compuestos bioactivos que le confieren gran potencial biotecnológico en la farmacología y biomedicina, así como en el control de plagas de importancia económica. La alcamida afinina es el bioactivo más importante presente en sus partes, principalmente en la raíz; no obstante, los extractos alcohólicos obtenidos de esta raíz han mostrado actividad biocida similar o incluso superior a la de la afinina purificada contra diversos organismos patógenos, posiblemente debido al efecto sinérgico de este compuesto y otros fitoquímicos presentes en los extractos. La investigación sobre las bondades de H. longipes no debe terminar en lo reportado hasta el día de hoy. Futuros trabajos pueden enfocarse en la optimización de los procesos de obtención de sus extractos, en el uso de técnicas no convencionales de extracción que puedan aminorar los impactos negativos al medio ambiente de las técnicas convencionales, en la formulación de alimentos funcionales a partir de H. longipes, así como en la búsqueda de las estrategias adecuadas para la preservación de sus principios activos y su adecuada aplicación en campo, evaluando sus niveles de ecotoxicidad, con miras hacia un escenario de prácticas sustentables para el control de plagas en la agri cultura. Asimismo, es importante continuar realizando estudios sobre su ecología y técnicas de cultivo para el aprovechamiento masivo e industrial de este importante recurso vegetal mexicano.

Figura 2. Usos y propiedades del chilcuague (Heliopsis longipes).
Descargue aquí el artículo en PDF
- García-Chávez, A.; Ramírez, E.; Molina-Torres, J. Acta Bot Mex 2004, No. 69, 115–131. ↩︎
- Bortolini, R. “OBTENCIÓN DE UN EXTRACTO CUANTIFICADO A PAR TIR DE LAS RAÍCES DE Heliopsis longipes CON EFECTO ANALGÉSICO. Tesis de Maestría, Universidad Autónoma de Querétaro, Querétaro, 2018 ↩︎
- Cilia-López, V. G.; Aguirre-Rivera, J. R.; Espinosa-Reyes, G.; Flores-Cano, J. A.; Reyes-Agüero, J. A.; Juárez-Flores, B. I. Revista Chapingo, Serie Ciencias Forestales y del Ambiente 2014, 20 (1), 47–53. https://doi.org/10.5154/r.rchscfa.2013.05.015. ↩︎
- Fotos de Chilcuán (Heliopsis longipes) · iNaturalist Ecuador. https://ecuador.inaturalist.org/taxa/289042-Heliopsis-longipes/browse_photos (accessed 2024-09-20). ↩︎
- Little Jr., E. L. Boletín de la Sociedad Botánica de México 1948, No. 7, 23–27. https://doi.org/10.17129/botsci.948. ↩︎
- Cilia-López, V. G.; Aguirre-Rivera, J. R.; Reyes-Agüero, J. A.; Juárez-Flores, B. I. Boletínde la Sociedad Botánica de México 2008, 83, 81–87. ↩︎
- Arellano-Perusquía, A.; Bañuelos-Hernández, B.; Urquieta-Ramírez, L.; Al barrán-Tamayo, F.; Aguilar-Ruiz, C. A.; González-Márquez, M. A.; Junquera Martínez, S.; Cruz-Hernández, A. In Endemic Species; IntechOpen, 2019. https://doi.org/10.5772/intechopen.83400. ↩︎
- . Rodeiro, I.; Donato, M. T.; Jimenez, N.; Garrido, G.; Molina-Torres, J.; Me nendez, R.; Castell, J. V; Gómez-Lechón, M. J. Phytotherapy Research 2009, 23, 279–282. https://doi.org/10.1002/ptr.2613. ↩︎
- Yohan, G.; Naga Sri, K. J.; Bhavani, N. L. D.; Devi, L.; Kumar, P. L.; Padmaja, V.; Navya Sri, V. Pakistan Heart Journal 2023, 56 (03), 608–613 ↩︎
- 10. Parola-Contreras, I.; Guevara-González, R. G.; Feregrino-Pérez, A. A.; Rey noso-Camacho, R.; Pérez-Ramírez, I. F.; Ocampo-Velázquez, R. V.; Rojas-Mo lina, A.; Luna-Vazquez, F.; Tovar-Pérez, E. G. Bot Sci 2021, 99 (1), 149–160. https://doi.org/10.17129/BOTSCI.2671. ↩︎
- . Déciga-Campos, M.; Rios, M. Y.; Aguilar-Guadarrama, A. B. Planta Med 2010, 76, 665–670. https://doi.org/10.1055/s-0029-1240658. ↩︎
- . Hernández, I.; Márquez, L.; Martínez, I.; Dieguez, R.; Delporte, C.; Prieto, S.; Molina-Torres, J.; Garrido, G. J Ethnopharmacol 2009, 124 (3), 649–652. https://doi.org/10.1016/j.jep.2009.04.060. ↩︎
- . Cilia-López, V. G.; Juárez-Flores, B. I.; Aguirre-Rivera, J. R.; Reyes-Agüero, J. A. Pharm Biol 2010, 48 (2), 195–200.
https://doi.org/10.3109/13880200903078495. ↩︎ - Arriaga-Alba, M.; Rios, M. Y.; Déciga-Campos, M. Pharm Biol 2013, 51 (8), 1035–1039. https://doi.org/10.3109/13880209.2013.775161. ↩︎
- Hernández-Morales, A.; Arvizu-Gómez, J. L.; Carranza-Álvarez, C.; Gómez Luna, B. E.; Alvarado-Sánchez, B.; Ramírez-Chávez, E.; Molina-Torres, J. J Asia Pac Entomol 2015, 18 (2), 227–231. https://doi.org/10.1016/j.as pen.2014.09.004. ↩︎
- . Molina-Torres, J.; Salazar-Cabrera, C.; Armenta-Salinas, C.; Ramírez-Chá vez, E. J Agric Food Chem 2004, 52 (15), 4700–4704.
https://doi.org/10.1021/jf034374y. ↩︎ - Molina-Torres, J.; García-Chávez, A.; Ramírez-Chávez, E.. J Ethnopharma col 1999, 64, 241–248. https://doi.org/10.1016/s0378-8741(98)00134-2. ↩︎
- . Cárdenas Ortega, N. C.; Pérez Gutiérrez, S.; Zavala Sánchez, M. A.; Aguirre Rivera, J. R.; Pérez González, C. Revista Mexicana de Ciencias Farmacéuticas 2005, 36 (3), 21–26. ↩︎
- Buitimea-Cantúa, G. V.; Buitimea-Cantúa, N. E.; del Refugio Rocha-Pizaña, M.; Rosas-Burgos, E. C.; Hernández-Morales, A.; Molina-Torres, J. J Environ Sci Health B 2020, 55 (3), 210–219. https://doi.org/10.1080/03601234.2019.1681818. ↩︎
- Ramírez-Chávez, E.; Lucas-Valdez, L.; Gil, V.-C.; Molina-Torres, J. Agro ciencia 2000, 34 (2), 207–215 ↩︎
- Damian Badillo, L. M.; Espinosa Madrigal, R. M.; Martinez Muñoz, R. E.; Ron Echeverria, O. A.; Salgado Garciglia, R.; Flores Garcia, A.; Raya Gonza lez, D.; Martínez Pacheco, M. M. Pharmacologyonline 2008, 3, 61–77 ↩︎
