Elizabeth Cortez Aguilar. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara, Guadalajara, Jalisco, México. e-mail: elizabeth.cortezaguilar6903@alumnos.udg.mx ORCID: https://orcid.org/0009-0006-4577-9240
Lazaro Pablo Fregoso Cruz. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara, Guadalajara, Jalisco, México. e-mail: lazaro.fregoso7342@alumnos.udg.mx ORCID: https://orcid.org/0009-0004-2339-8696
Miguel Salvador Plascencia Arreola. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara, Guadalajara, Jalisco, México. e-mail: miguel.plascencia4227@alumnos.udg.mx ORCID: https://orcid.org/0009-0005-6871-1911
Karla Guadalupe Ayala Miranda*. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara, Guadalajara, Jalisco, México. e-mail: karla.ayala@academicos.udg.mx ORCID: https://orcid.org/0009-0004-1650-5975
Resumen El microbioma materno, es un ecosistema complejo compuesto por diversas comunidades microbianas que habitan el intestino, la piel, la cavidad oral y el tracto vaginal, ejerce una influencia crítica y multifacética en el desarrollo neurológico del feto. Durante el periodo gestacional, el microbioma funciona como un órgano metabólico activo capaz de producir moléculas bioactivas, tales como los ácidos grasos de cadena corta (AGCC) y precursores de neurotransmisores, los cuales son capaces de atravesar la barrera placentaria. Estos compuestos modulan procesos neurobiológicos fundamentales como la neurogénesis, migración neuronal, sinaptogénesis y la maduración del sistema nervioso central fetal.
Palabras clave Microbioma materno, homeostasis, disbiosis, neurodesarrollo fetal, alimentación.
Cite este artículo así:
APA: Cortez-Aguilar, E. Fregoso-Cruz, L. Plascencia-Arreola, M. Ayala-Miranda, K*. (2025). Exploración del papel del microbioma materno y su impacto en el desarrollo neurológico del feto. Quimiofilia, 2025, 4, (2), 16-20. MDPI y JACS: Cortez-Aguilar, E.; Fregoso-Cruz, L.; Plascencia-Arreola, M.; Ayala-Miranda, K*. Quimiofilia, 2025, 4, 2, 16-20. DOI: https://doi.org/10.56604/qflaSC2025421620
Recibido: 07 de octubre 2025. Aceptado: 22 de octubre 2025. Publicado. 7 de diciembre de 2025. www.quimiofilia.com. ISSN: 2683-2364. Registro IMPI: 2052060 QUIMIOFILIA.Reserva de derechos al uso exclusivo 2022: 04-2019-062013201300-203
Introducción En los últimos años la comunidad científica se ha interesado por el estudio del microbioma; es decir, los microorganismos que habitan e interactúan con el cuerpo humano que forman un nicho biológico y tienen un papel fundamental en la homeostasis de este. Por lo que, una alteración en su composición desencadena un desequilibrio en las funciones que genera.1,2 Cabe resaltar que, el microbioma materno está implicado en múltiples procesos fisiológicos del feto,3 por lo que mantener un microbioma saludable reduce potencialmente los problemas del neurodesarrollo del feto, debido a que está asociado a abortos espontáneos, desarrollo somático, síndromes metabólicos, entre otros.4
El embarazo como ventana de programación neurológica El embarazo constituye una ventana temporal de neurogénesis durante el desarrollo embrionario, produciéndose un periodo crítico durante el cual se establecen los fundamentos para el desarrollo físico, inmunológico y cognitivo en la etapa posterior de la vida del individuo. Este complejo ecosistema microbiano en el intestino, la vagina, la piel y la cavidad oral, no solo es determinante para la salud materna, sino que ejerce una influencia profunda y directa sobre la funcionalidad del sistema nervioso central (SNC) del feto. Esta comunicación va más allá sobre las creencias que se tenían acerca del útero estéril.5 Aunque el feto no recibe bacterias vivas en un embarazo sano, sí está expuesto a un torrente de componentes microbianos como el lipopolisacárido (LPS) y a una inmensa diversidad de metabolitos que atraviesan la barrera placentaria. Esta exposición no es accidental; es un diálogo molecular que entrena al sistema inmune fetal y genera los procesos clave del cerebro en formación, como la mielinización, la eliminación de conexiones innecesarias (poda sináptica) y la configuración del eje hipotálamo-hipófisis-adrenal (HPA), que regirá la respuesta al estrés a lo largo de la vida del individuo.6 El microbioma vaginal, se caracteriza por tener baja diversidad, además de que la mayor cantidad de especies pertenecen al género Lactobacillus, las cuales producen ácido láctico cuyo objetivo es mantener un pH bajo.7 Este ambiente ácido es una barrera protectora contra patógenos que podrían causar infecciones ascendentes y, además, prepara el canal del parto para la colonización inicial del neonato, dado por transmisión vertical. Asimismo, el microbioma oral ha sido asociado con la salud sistémica; patologías como la enfermedad periodontal durante el embarazo se relaciona con un aumento de la inflamación sistémica y un mayor riesgo de complicaciones como la preeclampsia.7
Cambios fisiológicos y factores moduladores del microbioma durante el embarazo El embarazo provoca grandes transformaciones en el cuerpo de la mujer, incluyendo una reorganización completa de su microbioma. Lo anterior es impulsado por cambios hormonales, inmunológicos y metabólicos, diseñados para favorecer el desarrollo del feto, pero también vuelve a la comunidad microbiana más susceptible a influencias externas. La microbiota materna es dinámica y sensible a múltiples factores ambientales y estilos de vida que pueden favorecer la homeostasis o la disbiosis.8 Una dieta alta en grasas o azúcares, estrés y la obesidad materna también han sido identificados como factores de riesgo de disbiosis.8 El aumento de la edad materna, por ejemplo, está asociado con cambios en la composición de microbiota intestinal que persisten en la descendencia, influyendo en la producción de neurotransmisores y metabolitos tanto en la sangre como en el cerebro.9 El uso de antibióticos durante el embarazo es otro factor crítico, ya que su consumo puede eliminar especies bacterianas beneficiosas, comprometiendo la transferencia de un microbioma materno saludable al neonato y alterando la colonización inicial del recién nacido.10,11 En conjunto, la interacción de todos estos factores es decisiva para configurar el ambiente en el que se desarrolla el bebé, influyendo directamente en el riesgo de presentar complicaciones durante el embarazo y sentando las bases para la salud a largo plazo tanto de la madre como del niño.7
Eje microbiota-intestino-cerebro: Mecanismos implicados en el neurodesarrollo fetal
Durante el embarazo, se establece una fascinante red de comunicación bidireccional conocida como el eje microbiota-intestino-cerebro, que conecta la microbiota intestinal de la madre con su sistema nervioso central y, de manera crucial, se extiende para contribuir en el desarrollo del cerebro del feto.6 En la figura 1 se puede visualizar esta comunicación que se establece a través de un complejo eje materno-fetal, donde los metabolitos microbianos actúan como mensajeros biológicos.³ Estudios en modelos animales, como el realizado en ratones libres de gérmenes, han demostrado que la ausencia de microbiota materna altera significativamente la expresión génica en el intestino, cerebro y placenta del feto. Los metabolitos, incluyendo los derivados del triptófano, ácidos grasos de cadena corta (AGCC) y otros compuestos aromáticos, pueden atravesar la placenta y la barrera hematoencefálica fetal o por sus siglas en inglés Blood-Brain-Barrier (BBB), regulando la expresión de genes clave para el desarrollo neuronal, la función inmunológica y el metabolismo.4,8
La comunicación entre el microbioma materno y el feto se lleva a cabo a través de tres vías principales:
Vía metabólica: las bacterias intestinales procesan la fibra que el cuerpo no puede digerir y producen metabolitos como los ácidos grasos de cadena corta (AGCC). El butirato, no solo fortalece la barrera intestinal, sino que también actúa a nivel epigenético, debido a que al cruzar la placenta modula la expresión de genes para el desarrollo cerebral fetal, así como aquellos relacionados con el BDNF (Brain-Derived Neurotrophic Factor, Factor Neurotrófico Derivado del Cerebro), que desempeña un papel clave en la plasticidad sináptica.12
Otros AGCC, como el propionato y el acetato, actúan directamente en el cerebro e influyen en la producción de neurotransmisores. Cuando se tiene un microbioma sano el triptófano se transforma en serotonina, favoreciendo el desarrollo cerebral. Si hay desequilibrio o disbiosis, el mismo triptófano, genera quinurenina, el cual afecta negativamente al cerebro del feto.13
Vía inmunológica: un desequilibrio en la microbiota puede dañar la barrera intestinal, permitiendo que componentes bacterianos como el LPS pasen a la sangre de la madre. Esto desencadena una respuesta inflamatoria generalizada, llamada Activación Inmune Materna (AIM), que se caracteriza por un aumento de citoquinas proinflamatorias (como IL-6, IL-17a y TNF-α).12 Estas citoquinas pueden atravesar la placenta y afectar directamente al cerebro del feto. Su principal blanco son las microglías, las células inmunitarias del cerebro. Una activación anormal de estas células puede alterar procesos de desarrollo cerebrales como las conexiones neuronales y la formación de mielina, por lo que se vincula con diversos trastornos del neurodesarrollo.12
Vía neuronal: El nervio vago actúa como una autopista neural directa que va desde el intestino hasta el tronco encefálico. Los metabolitos producidos por las bacterias pueden estimular las terminaciones de este nervio en el intestino, enviando señales eléctricas rápidas al cerebro de la madre. Esto puede influir en su estado anímico y sus niveles de estrés que impacta el ambiente fetal a través de la liberación de hormonas.12,13
Microbioma materno, disbiosis y riesgo de trastornos del neurodesarrollo El desequilibrio en la microbiota intestinal de la madre, conocido como disbiosis, es hoy reconocido como un factor de riesgo ambiental importante para que su hijo desarrolle trastornos neuropsiquiátricos en el futuro. (Tabla 1)
Numerosas investigaciones, tanto en humanos como en modelos animales, vinculan de forma sólida la disbiosis materna con un mayor riesgo de que la descendencia presente, por ejemplo:
Trastorno del Espectro Autista (TEA): estudios con animales muestran que la inflamación gestacional provoca conductas similares al autismo, vinculadas a un malfuncionamiento de las células microgliales, que son vitales para establecer las conexiones cerebrales durante el desarrollo.7,14
Trastorno por Déficit de Atención e Hiperactividad (TDAH): se sugiere que la alteración en los niveles de neurotransmisores claves como la dopamina y la serotonina podrían ser una causa subyacente.9
Trastornos de ansiedad: la exposición a un entorno inflamatorio en el útero puede programar el sistema de respuesta al estrés del bebé para que sea hiperreactivo, incrementando su predisposición a sufrir ansiedad a lo largo de su vida.7
Esquizofrenia: la activación del sistema inmune materno es uno de los factores de riesgo más consistentes para esta enfermedad, probablemente porque interfiere en la maduración normal de los circuitos cerebrales en momentos críticos del desarrollo.9,14
Transmisión vertical y colonización microbiana del neonato La forma en que nace un bebé determina la comunidad de bacterias que colonizarán su cuerpo, esto principalmente se da a través de la transmisión vertical por la madre cuando tiene parto vaginal natural, el recién nacido se impregna de las bacterias de la vagina y el intestino de su madre. Esta exposición inicial sienta las bases para poblar su propio intestino, piel y mucosas. Los tipos de bacterias que adquiere, predominantemente Lactobacillus y Prevotella, son especialmente beneficiosas. En recién nacidos, se ha reportado que durante los primeros 3 a 7 días de vida alrededor del 72% del microbioma materno pasa al recién nacido por el canal vaginal.6,13 Por el contrario, un nacimiento por cesárea priva al bebé de esta inoculación fundamental. En su lugar, su primer contacto microbiano proviene principalmente del ambiente del hospital y de la piel de la madre, por lo que su microbioma estará dominado por bacterias como Staphylococcus y Corynebacterium. Esta diferencia inicial en la colonización se ha vinculado a un desarrollo inmunológico alterado y se asocia a un mayor riesgo de desarrollar afecciones como alergias, asma, enfermedades autoinmunes e incluso algunos trastornos del neurodesarrollo durante la infancia.6,14
Conclusiones El microbioma materno tiene un papel fundamental en la regulación de la homeostasis durante la gestación, su impacto se asocia más allá de la salud de la madre, impacta directamente en el desarrollo fetal. Se ha evidenciado que los metabolitos derivados del triptófano, ácidos grasos de cadena corta y otros compuestos pueden atravesar la placenta y la barrera hematoencefálica fetal regulando la expresión de genes clave para el neurodesarrollo, la función neurológica y el metabolismo. La composición del microbioma materno depende fundamentalmente de la alimentación, por lo cual, una dieta alta en fibra propicia el crecimiento de bacterias beneficiosas para el organismo y promueve una homeostasis en el cuerpo. Por lo contrario, una dieta alta en azúcares y alimentos procesados induce a la disbiosis o desequilibrio y propicia el crecimiento de bacterias que alteran los procesos fisiológicos, de regulación inmunitaria e incrementa el síndrome metabólico, que consecuentemente a través del eje materno-fetal, alterará su neurodesarrollo afectando directamente neurotransmisores, se incrementa el riesgo de presentar abortos espontáneos. En conclusión, durante el embarazo, la madre no solo es portadora del feto, sino tiene un papel importante en la regulación del ambiente biológico en el que éste se desarrolla. Cuidar de la alimentación y mantener un equilibrio en la microbiota materna no solo favorece la homeostasis, sino que también asegura mejores condiciones para el crecimiento, la maduración neurológica y la salud futura del recién nacido.
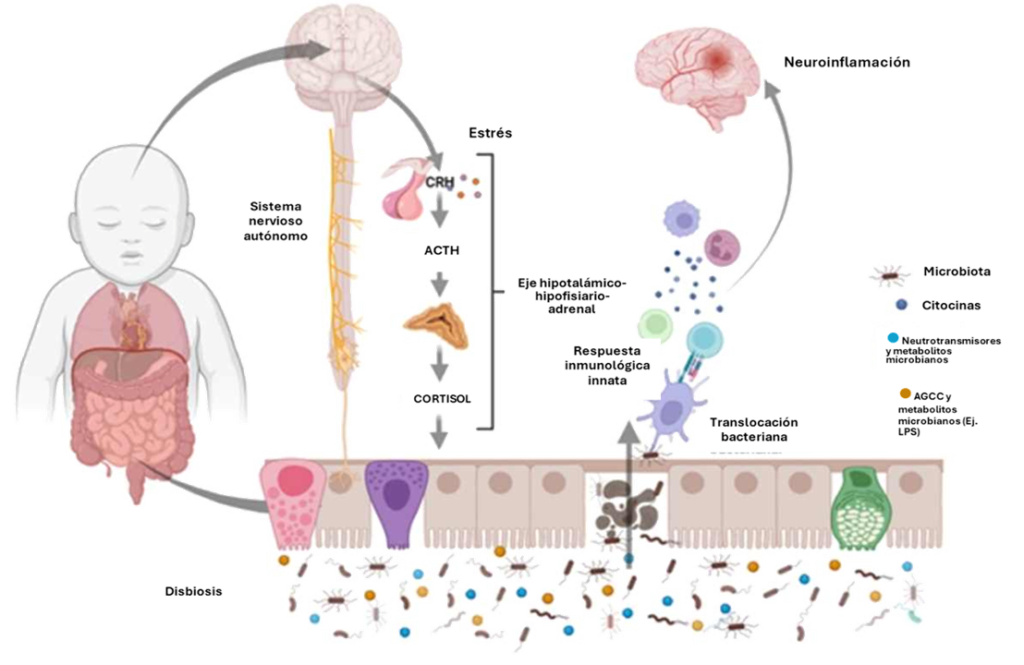
Figura 1: Interrelación entre microbioma materno y desarrollo cerebral fetal. En esta figura se representa la comunicación bidireccional entre el microbioma intestinal materno, la placenta y el cerebro fetal a través de metabolitos y señales inmunes, tomada de Fernández Becerra.15
Tabla 1. Comparativa del impacto de los factores sobre el microbioma y el neurodesarrollo.

Descargue aquí el artículo en PDF
- Núñez, I.; Uzcátegui Montero, O. E.; Sandó Mistage, C.; Terrizzi, A.; Milano, A.; Martínez, B. Current Aspects of the Microbiota and Its Relationship with Pregnancy. Rev. Obstet. Ginecol. Venez. 2024, 84 (4), 450–458. https://doi.org/10.51288/00840414. ↩︎
- Hudobenko, J.; Di Gesù, C. M.; Mooz, P. R.; Petrosino, J.; Putluri, N.; Ganesh, B. P.; Rebeles, K.; Blixt, F. W.; Venna, V. R.; McCullough, L. D. Maternal Dysbiosis Produces Long-Lasting Behavioral Changes in Offspring. Mol. Psychiatry 2025, 30 (5), 1847–1858. https://doi.org/10.1038/s41380-024-02794-0. ↩︎
- Biagioli, V.; Matera, M.; Ramenghi, L. A.; Falsaperla, R.; Striano, P. Microbiome and Pregnancy Dysbiosis: A Narrative Review on Offspring Health. Nutrients 2025, 17 (6), 1033. https://doi.org/10.3390/nu17061033. ↩︎
- Márquez-Ibarra, A. A.; Mariscal-Ramírez, B. E.; González-Ponce, A. M.; Valbuena-Gregorio, E. Cambios en la microbiota durante el embarazo: Revisión narrativa. Ginecol. Obstet. Mex. 2023, 91 (7), 499–515. https://doi.org/10.24245/gom.v91i7.8684. ↩︎
- Olasunkanmi. Maternal Gut-Microbiota Impacts the Influence of Intrauterine Environmental Stressors on the Modulation of Human Cognitive Development and Behaviour. J. Psychiatr. Res. 2024. https://doi.org/10.1016/j.jpsychires.2024.10.028. ↩︎
- Morais, L. H.; Schreiber, H. L.; Mazmanian, S. K. The Gut Microbiota–Brain Axis in Behaviour and Brain Disorders. Nat. Rev. Microbiol. 2020, 19 (4), 241–255. https://doi.org/10.1038/s41579-020-00460-0. ↩︎
- Rogers, G. B.; Keating, D. J.; Young, R. L.; Wong, M.-L.; Licinio, J.; Wesselingh, S. From Gut Dysbiosis to Altered Brain Function and Mental Illness: Mechanisms and Pathways. Mol. Psychiatry 2016, 21 (6), 738–748. https://doi.org/10.1038/mp.2016.50. ↩︎
- Pérez-Paredes, S.; Rodríguez-Rico, C. R.; Ramírez-Valdez, J. M. Disbiosis en el embarazo. Arch. Med. Sanit. 2023, 8, 21–34. https://doi.org/10.46313/ams.v8i1.428. ↩︎
- Rocafull, D.; Arrieta, M. C. Maternal Microbiota and Neurodevelopmental Disorders: A Critical Review of the Evidence. Curr. Dev. Disord. Rep. 2023, 10, 1–12. https://doi.org/10.1007/s40474-023-00287-3. ↩︎
- Orchanian, S. B.; Hsiao, E. Y. The Microbiome as a Modulator of Neurological Health across the Maternal–Offspring Interface. J. Clin. Invest. 2025, 135 (4), e184314. https://doi.org/10.1172/JCI184314. ↩︎
- Alagiakrishnan, K.; Morgadinho, J.; Halverson, T. Approach to the Diagnosis and Management of Dysbiosis. Front. Nutr. 2024, 11, 1330903. https://doi.org/10.3389/fnut.2024.1330903. ↩︎
- Wang, Y.; Xie, T.; Wu, Y.; Liu, Y.; Zou, Z.; Bai, J. Impacts of Maternal Diet and Alcohol Consumption during Pregnancy on Maternal and Infant Gut Microbiota. Biomolecules 2021, 11, 369. https://doi.org/10.3390/biom11030369 ↩︎
- Suprunowicz, M.; Tomaszek, N.; Urbaniak, A.; Zackiewicz, K.; Modzelewski, S.; Waszkiewicz, N. Between Dysbiosis, Maternal Immune Activation and Autism: Is There a Common Pathway? Nutrients 2024, 16 (4), 549. https://doi.org/10.3390/nu16040549. ↩︎
- Shao, Y.; Forster, S. C.; Tsaliki, E.; Vervier, K.; Strang, A.; Simpson, N.; Kumar, N.; Stares, M. D.; Rodger, A.; Brocklehurst, P.; Field, N.; Lawley, T. D. Stunted Microbiota and Opportunistic Pathogen Colonization in Caesarean-Section Birth. Nature 2019, 574 (7776), 117–121. https://doi.org/10.1038/s41586-019-1560-1 ↩︎
- Fernández-Becerra, F. J.; Miranda-García, L.; Briseño-Sahagun, P. El papel de la microbiota en el desarrollo neurológico de prematuros (Microbiota Role in the Neurodevelopment of Premature Infants). Rev. Med. UAS 2023, 13 (4), octubre–diciembre. https://doi.org/10.28960/revmeduas.2007-8013.v13.n4.011. ↩︎
