Efrain Aguirre Sandoval. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: efrain.aguirre0411@alumnos.udg.mx
ORCID: https://orcid.org/0009-0002-2000-7835
Alexis Manuel Álvarez Franco. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: alexis.alvarez7652@alumnos.udg.mx.
ORCID: https://orcid.org/0009-0007-2387-6565
Alondra Jacqueline Ruvalcaba Mendoza.
Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: alondra.ruvalcaba5596@alumnos.udg.mx.
ORCID: https://orcid.org/0009-0001-6819-6674
Martin Zermeño Ruiz*. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: martinzermeno@academicos.udg.mx
Resumen
La Enfermedad de Alzheimer (EA) es una patología neurodegenerativa progresiva y la principal causa de demencia a nivel mundial, caracterizada por la acumulación de proteína β-amiloide (Aβ) y tau hiperfosforilada que deterioran funciones cognitivas como la memoria, el lenguaje y la orientación. Su alta prevalencia, estimada en más de 60 millones de personas a nivel global y 1.3 millones en México, ha motivado la búsqueda de factores asociados a su progresión. En este contexto, la microbiota intestinal ha cobrado gran relevancia, ya que estudios recientes han demostrado que la disbiosis puede contribuir a la neuroinflamación y a la formación de depósitos amiloides. Dentro de esta alteración, ciertas bacterias como Escherichia coli (E. coli), se han relacionado directamente con la patogénesis del Alzheimer debido a su capacidad de liberar proteínas amiloideas bacterianas llamadas curli, que presentan similitudes estructurales con la Aβ humana. Estas proteínas, junto con el lipopolisacárido (LPS), activan mecanismos inflamatorios como el inflamasoma NLRP3, generando la liberación de citoquinas proinflamatorias que favorecen la neurodegeneración. Adicionalmente, la disbiosis y el incremento de E. coli alteran la permeabilidad intestinal, lo que facilita la translocación de estas moléculas hacia el sistema nervioso central a través del eje intestino-cerebro, exacerbando la inflamación y potenciando la progresión de la enfermedad.Estos hallazgos sugieren queE. coli podría desempeñar un papel relevante en la neuroinflamación y en la acumulación de proteínas amiloides, favoreciendo la progresión de la enfermedad.
Palabras clave
Enfermedad de Alzheimer; Escherichia coli.; microbiota intestinal; proteína β-amiloide.
Introducción
La Enfermedad de Alzheimer (EA) es una patología neurodegenerativa progresiva y la causa más común de demencia a nivel mundial. Se distingue por presentar alteraciones que afectan principalmente al lóbulo temporal, provocando el deterioro de funciones cognitivas como la memoria, dificultades en el lenguaje y desorientación o capacidad de razonamiento, entre otros síntomas. De acuerdo con la Organización Mundial de la Salud (OMS), aproximadamente 60 millones de personas padecen EA a nivel global, con una mayor prevalencia en mujeres mayores de 65 años. En México, se estima que alrededor de 1.3 millones de personas viven con esta enfermedad, representando entre el 60 % y 70 % de los diagnósticos de demencia (ver Gráfica 1).1
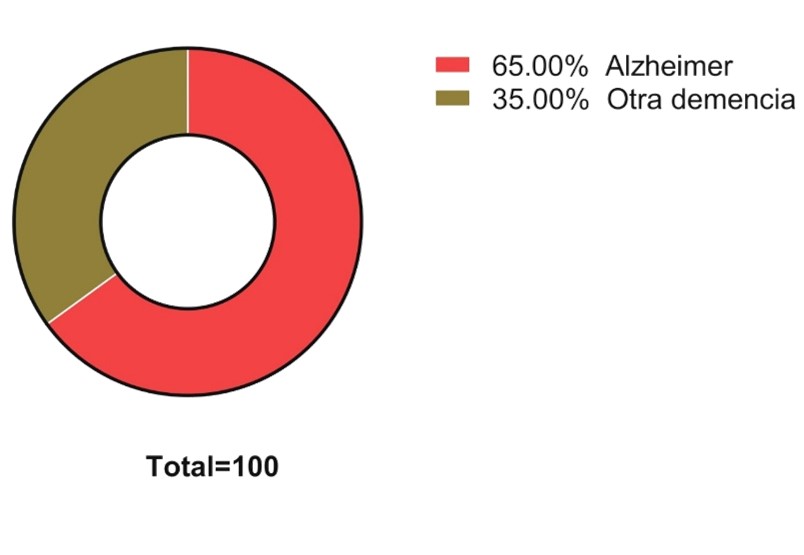
Gráfica 1. Representación gráfica sobre la presencia de Alzheimer a comparación de otros tipos de demencia en México.1
Aunque los mecanismos que favorecen la progresión del Alzheimer no están del todo comprendidos, se ha propuesto que la microbiota intestinal desempeña un papel clave. La disbiosis puede promover inflamación periférica y cerebral, así como la formación de amiloide y deterioro cognitivo. En este proceso, bacterias como E. coli liberan proteínas curli, similares a la Aβ, capaces de activar el inflamasoma NLRP3, hallado en niveles elevados en pacientes con EA. Este trabajo busca profundizar en cómo E.coli puede contribuir a la neuroinflamación y acumulación de amiloide, aportando bases para entender mejor la enfermedad y generar nuevas estrategias de prevención y tratamiento.2
Enfermedad de Alzheimer
La EA se caracteriza principalmente por la acumulación anormal de proteína Aβ, en forma de placas extracelulares y proteína tau hiperfosforilada en ovillos neurofibrilares, lo que genera disfunción sináptica y muerte neuronal. Entre los principales factores de riesgo destacan la edad avanzada, con mayor prevalencia en mujeres, así como mutaciones genéticas y antecedentes familiares. Es importante comprender la fisiopatología que conlleva esta enfermedad, ya que, en condiciones fisiológicas, la proteína precursora amiloide (APP) y tau cumplen funciones esenciales en el mantenimiento neuronal; En condiciones normales, la APP y tau cumplen funciones esenciales para el mantenimiento neuronal. Por otro lado, en la vía amiloidogénica (patológica) producen fragmentos que originan Aβ40 y especialmente Aβ42 formando las placas que alteran la comunicación neuronal y activan procesos inflamatorios. En el caso de tau, normalmente estabiliza los microtúbulos dentro de las neuronas, al verse alterado en esta patología, se hiperfosforila acumulándose en ovillos neurofibrilares que causan disfunción en el transporte neuronal y muerte celular.3
Aunque estos mecanismos son considerados como un enfoque principal de la patología, factores externos como la microbiota intestinal pueden modular la inflamación cerebral. En ocasiones cuando se abusa del uso de antibióticos o no se tiene una dieta equilibrada, pueden provocar un desequilibrio de la microbiota intestinal, conocido formalmente como disbiosis, esto produce una proliferación anormal de ciertas bacterias, como E. coli, su abundancia en la microbiota conlleva a un aumento en la producción de biopelículas y proteínas amiloides bacterianas como curli, que a través de un mecanismo de comunicación bidireccional que involucra al sistema nervioso e inmune conocido como eje intestino-cerebro mediado directamente y en parte por el nervio vago, permite que se generen respuestas inflamatorias en el cerebro.4
Proteínas amiloides bacterianas y su papel en la neuroinflamación
En términos generales, los microorganismos suelen organizarse en comunidades estructurales conocidas como biopelículas para resistir a condiciones adversas, estas estructuras se encuentran protegidas por una matriz extracelular conformada principalmente por amiloides bacterianos. Estas son proteínas caracterizadas por poseer una estructura constituida de láminas β cruzadas, cuya función principal es su capacidad de dar estabilidad a estas estructuras y favorecer la adherencia a superficies, proporcionando así una fuerte protección contra varias agresiones ambientales y del huésped. Debido a su similitud estructural con Aβ, se plantea que podrían generar una respuesta inmunitaria cruzada, exacerbando la inflamación y contribuyendo al daño neuronal.5
En condiciones normales, las bacterias entéricas representan menos del 0.1 % de la microbiota intestinal, pero durante la disbiosis pueden aumentar notablemente. En este contexto, E. coli tienen la capacidad de liberar proteínas amiloides bacterianas denominadas curli; estructuralmente similares a la β-amiloide humana. Estas proteínas no solo forman parte de biopelículas, sino que también son reconocidas por el sistema inmune, generando anticuerpos y actuando como patrones moleculares asociados a patógenos (PAMPs) como los lipopolisacáridos (LPS), por lo que por distintos mecanismos pueden contribuir de manera sinérgica al desarrollo y progresión de la EA.6
Mecanismo de neuroinflamación inducido por curli y LPS en la Enfermedad de Alzheimer
Durante un estado de disbiosis intestinal, el aumento de E. coli favorece la producción de LPS y de proteínas amiloides bacterianas como curli. La translocación de curli del intestino al cerebro ocurre a través del eje intestino-cerebro, algunos estudios señalan que se lleva a cabo especialmente por el nervio vago, que conecta el tracto gastrointestinal con el cerebro. Debido a su similitud estructural a las proteínas β-amiloide humanas, curli es reconocido por receptores del sistema inmune innato tipo Toll 2 (TLR2), los cuales son clave para reconocer la estructura común de lámina beta compartida por curli y Aβ; una vez reconocido el patógeno se activan células gliales como la microglía y los astrocitos que producen mediadores inflamatorios, además facilitan la internalización de curli a través de este receptor, ya que debido a su estructura fibrilar, los amiloides son capaces de romper el endosoma, accediendo así al citosol. Una vez dentro del citosol, los amiloides activan otros sensores citosólicos, uno de los cuales es el inflamasoma NLRP3. Esta activación provoca la liberación de citoquinas proinflamatorias, tales como IL-1β y IL-18 creando un entorno inflamatorio que exacerba la neurodegeneración crónica en la EA.7
Adicionalmente este desequilibrio altera la permeabilidad intestinal, permitiendo la fuga de LPS y en menor medida curli al torrente sanguíneo. Una vez en circulación, estos productos comprometen la barrera hematoencefálica, fenómeno que ocurre tanto durante el envejecimiento como en procesos inflamatorios crónicos, activando la microglía y potenciando la liberación de citoquinas proinflamatorias, favoreciendo la acumulación de Aβ y tau, contribuyendo a la neuroinflamación en el Alzheimer. Dado que la microbiota intestinal produce tanto LPS como amiloides curli, es plausible considerar que la interacción sinérgica de estas moléculas podría conducir a la amplificación de la neuroinflamación y posterior neurodegeneración en la Enfermedad de Alzheimer (Figura 1).8,9
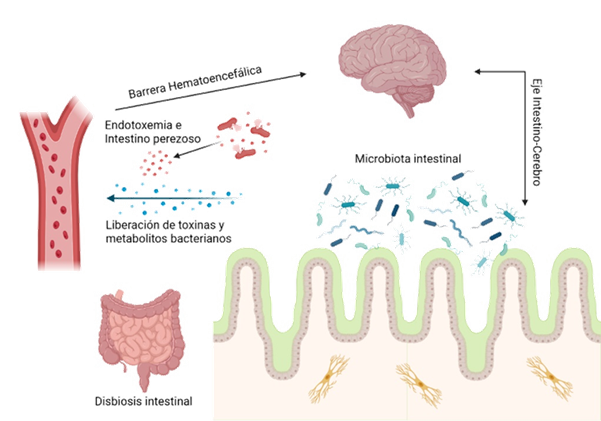
Figura 1. Eje intestino-cerebro como vía de neuroinflamación inducida por disbiosis intestinal. Basada y modificada de Tarawneh, R.9
Evidencias actuales e implicaciones
Diversos estudios en modelos animales muestran que el microbioma intestinal influye en el deterioro cognitivo y en la progresión del Alzheimer, favoreciendo la acumulación de Aβ, tau y la neuroinflamación.10Por otro lado, se ha registrado una relación entre una mayor carga bacteriana intestinal y niveles altos de péptidos antimicrobianos contra bacterias en modelos donde se presenta una taupatía, esto sugiere la presencia de una respuesta inmune innata mejorada a la microbiota intestinal.11 Datos en ratones con EA sugieren que el microbioma intestinal está enriquecido con especies proinflamatorias destacando a E. coli. y que la disbiosis intestinal aumenta con la edad.12 lo que respalda un modelo de “retroalimentación directa” entre la patología y los cambios microbianos. Esta teoría se respalda por observaciones donde los cambios microbianos intestinales a menudo se observan antes de la agregación amiloide cerebral, añadiendo que los modelos que no presentan microbiota intestinal desarrollan una menor cantidad de Aβ que aquellos con microbiota intestinal.13
Estudios recientes en humanos indican que en la etapa preclínica del Alzheimer se observa un aumento de Bacteroidetes y disminución de Firmicutes, y que combinar este perfil intestinal con el estado cognitivo y los niveles plasmáticos de Aβ permite detectar la enfermedad con una precisión de hasta el 87 %.14,15
Conclusión
La variación de E. coli en la microbiota intestinal puede favorecer la presencia de amiloides bacterianos como curli, los cuales activan el inflamasoma NLRP3 y desencadenan citoquinas proinflamatorias que potencialmente contribuyen a la neurodegeneración en la EA. El estudio de la disbiosis, junto con el papel del eje intestino-cerebro, permite identificar biomarcadores clave y abre nuevas perspectivas para desarrollar intervenciones basadas en la regulación del microbioma intestinal se requieren de más investigaciones relacionadas con este fenómeno las cuales colocan este enfoque como una estrategia innovadora contra el Alzheimer.
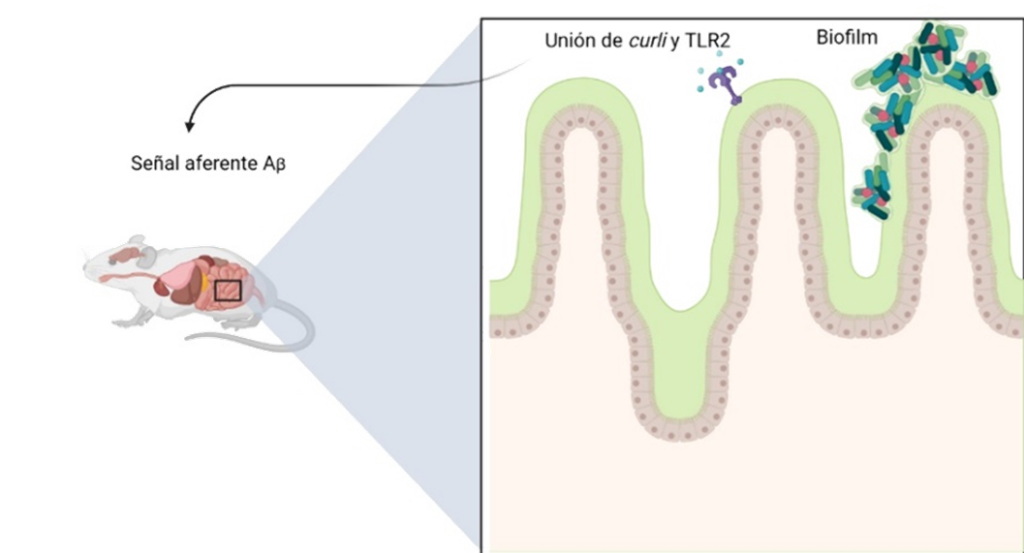
Figura 2. Eje intestino-cerebro en ratón. Basada y modificada de Sasayama, Das, T.K.15
Descargue aquí el artículo en PDF
- Lew, C. O.; Zhou, L.; Mazurowski, M. A.; Doraiswamy, P. M.; Petrella, J. R. MRI-Based Deep Learning Assessment of Amyloid, Tau, and Neurodegeneration Biomarker Status across the Alzheimer Disease Spectrum. Radiology 2023, 309 (1). https://doi.org/10.1148/radiol.222441 ↩︎
- Wang, Q.; Schindler, S. E.; Chen, G.; McKay, N. S.; McCullough, A.; Flores, S.; Liu, J.; Sun, Z.; Wang, S.; Wang, W.; Hassenstab, J.; Cruchaga, C.; Perrin, R. J.; Fagan, A. M.; Morris, J. C.; Wang, Y.; Benzinger, T. L. S. Investigating White Matter Neuroinflammation in Alzheimer Disease Using Diffusion-Based Neuroinflammation Imaging. Neurology 2024, 102 (4). https://doi.org/10.1212/WNL.0000000000208013 ↩︎
- Gubert, C.; Kong, G.; Renoir, T.; Hannan, A. J. Exercise, Diet and Stress as Modulators of Gut Microbiota: Implications for Neurodegenerative Diseases. Neurobiol. Dis. 2020, 134, 104621. https://doi.org/10.1016/j.nbd.2019.104621 ↩︎
- Sánchez-Tapia, M.; Mimenza-Alvarado, A.; Granados-Domínguez, L.; Flores-López, A.; López-Barradas, A.; Ortiz, V.; Pérez-Cruz, C.; Sánchez-Vidal, H.; Hernández-Acosta, J.; Ávila-Funes, J. A.; Guevara-Cruz, M.; Tovar, A. R.; Torres, N. The Gut Microbiota–Brain Axis during Aging, Mild Cognitive Impairment and Dementia: Role of Tau Protein, β-Amyloid and LPS in Serum and Curli Protein in Stool. Nutrients 2023, 15 (4), 932. https://doi.org/10.3390/nu15040932 ↩︎
- Askarova, S.; Umbayev, B.; Masoud, A.-R.; Kaiyrlykyzy, A.; Safarova, Y.; Tsoy, A.; Olzhayev, F.; Kushugulova, A. The Links between the Gut Microbiome, Aging, Modern Lifestyle and Alzheimer’s Disease. Front. Cell. Infect. Microbiol. 2020, 10, 104. https://doi.org/10.3389/fcimb.2020.00104 ↩︎
- Makdissi, S.; Parsons, B. D.; Di Cara, F. Towards Early Detection of Neurodegenerative Diseases: A Gut Feeling. Front. Cell Dev. Biol. 2023, 11, 1087091. https://doi.org/10.3389/fcell.2023.1087091 ↩︎
- Giovannini, M. G.; Lana, D.; Traini, C.; Vannucchi, M. G. The Microbiota–Gut–Brain Axis and Alzheimer Disease. From Dysbiosis to Neurodegeneration: Focus on the Central Nervous System Glial Cells. J. Clin. Med. 2021, 10 (11), 2358. https://doi.org/10.3390/jcm10112358 ↩︎
- You, M.; Chen, N.; Yang, Y.; Cheng, L.; He, H.; Cai, Y.; Liu, Y.; Liu, H.; Hong, G. The Gut Microbiota–Brain Axis in Neurological Disorders. MedComm 2024, 5 (8), e656. https://doi.org/10.1002/mco2.656 ↩︎
- Tarawneh, R.; Penhos, E. The Gut Microbiome and Alzheimer’s Disease: Complex and Bidirectional Interactions. Neurosci. Biobehav. Rev. 2022, 141, 104814. https://doi.org/10.1016/j.neubiorev.2022.104814 ↩︎
- Wang, Y. The Role of the Gut Microbiota and Microbial Metabolites in the Pathogenesis of Alzheimer’s Disease. CNS Neurol. Disord. Drug Targets 2022, 21 (4), 511–518. https://doi.org/10.2174/1871527321666220417005115 ↩︎
- Rydbom, J.; Kohl, H.; Hyde, V. R.; Lohr, K. M. Altered Gut Microbial Load and Immune Activation in a Drosophila Model of Human Tauopathy. Front. Neurosci. 2021, 15, 731602. https://doi.org/10.3389/fnins.2021.731602 ↩︎
- Chen, Y.; Fang, L.; Chen, S.; Zhou, H.; Fan, Y.; Lin, L.; Li, J.; Xu, J.; Chen, Y.; Ma, Y.; Chen, Y. Gut Microbiome Alterations Precede Cerebral Amyloidosis and Microglial Pathology in a Mouse Model of Alzheimer’s Disease. BioMed Res. Int. 2020, 2020, 8456596. https://doi.org/10.1155/2020/8456596 ↩︎
- Dodiya, H. B.; Frith, M.; Sidebottom, A.; Cao, Y.; Koval, J.; Chang, E.; Sisodia, S. S. Synergistic Depletion of Gut Microbial Consortia, but Not Individual Antibiotics, Reduces Amyloidosis in APPPS1-21 Alzheimer’s Transgenic Mice. Sci. Rep. 2020, 10 (1), 64797. https://doi.org/10.1038/s41598-020-64797-5 ↩︎
- Sheng, C.; Yang, K.; He, B.; Du, W.; Cai, Y.; Han, Y. Combination of Gut Microbiota and Plasma Amyloid-β as a Potential Index for Identifying Preclinical Alzheimer’s Disease: A Cross-Sectional Analysis from the SILCODE Study. Alzheimers Res. Ther. 2022, 14 (1), 977. https://doi.org/10.1186/s13195-022-00977-x ↩︎
- Das, T. K.; Blasco-Conesa, M. P.; Korf, J.; Honarpisheh, P.; Chapman, M. R.; Ganesh, B. P. Bacterial Amyloid Curli Associated Gut Epithelial Neuroendocrine Activation Predominantly Observed in Alzheimer’s Disease Mice with Central Amyloid-β Pathology. J. Alzheimers Dis. 2022, 88 (1), 191–205. DOI: 10.3233/JAD-220106 ↩︎
