Nancy Elizabeth Franco Rodríguez*. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México
e-mail: nancy.frodriguez@academicos.udg.mx
ORCID: https://orcid.org/0000-0001-9195-8289
Rubén Elías Millares Jasso. Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: ruben.millares1031@alumnos.udg.mx
José Trinidad Guillen Bonilla. Departamento de Electro-Fotónica, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: trinidad.guillen@academicos.udg.mx
ORCID: https://orcid.org/0000-0003-0041-3932
Adriana Cavazos Garduño. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: adriana.cavazos@academicos.udg.mx
ORCID: https://orcid.org/0000-0002-3077-5371
Julio César Serrano Niño. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: ; julio.serrano@academicos.udg.mx
ORCID: https://orcid.org/0000-0001-8873-5340
César Ricardo Cortez Álvarez. Departamento de Farmacobiología, Centro Universitario de Ciencias Exactas e Ingenierías, Universidad de Guadalajara. Guadalajara, Jalisco, México.
e-mail: cesar.cortez@academicos.udg.mx
Resumen
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo progresivo caracterizado por la agregación de la proteína α-sinucleína en estructuras patológicas llamadas cuerpos de Lewy. Evidencia científica reciente ha revelado una asociación significativa entre la presencia de bacterias del género Desulfovibrio en la microbiota intestinal y el desarrollo de la EP. Estudios realizados en pacientes con EP han demostrado niveles más altos de Desulfovibrio en comparación con individuos sanos, correlacionándose directamente con la gravedad clínica de la enfermedad. Estas bacterias reductoras de sulfato producen metabolitos tóxicos como el sulfuro de hidrógeno (H₂S), lipopolisacáridos (LPS) y nanopartículas de magnetita, los cuales pueden inducir plegamientos anormales y agregación de la proteína α-sinucleína. Dichas proteínas anómalas se relacionan con la formación de cuerpos de Lewy, detectados tanto en tejido intestinal como en el sistema nervioso central y periférico de pacientes con EP, constituyendo un biomarcador ampliamente reconocido de la enfermedad. Se ha propuesto que la disbiosis intestinal promueve la progresión de la enfermedad a través del eje microbiota-intestino-cerebro, posiblemente mediado por el nervio vago. En este contexto, los metabolitos bacterianos tóxicos inducen inflamación crónica y respuestas neuroinflamatorias que contribuyen significativamente a la patogénesis de la EP. Estos hallazgos sugieren que el análisis del microbioma intestinal podría constituir un biomarcador temprano para la detección de riesgo, abriendo nuevas vías para el desarrollo de estrategias preventivas y terapéuticas.
Palabras Clave
Desulfovibrio spp., disbiosis, Parkinson, α-sinucleína, cuerpos de Lewy.
Cite este artículo así:
APA: Franco-Rodríguez, N*. Millares-Jasso, R. Guillen-Bonilla, J. Cavazos-Garduño, A. Serrano-Niño, J. Cortez-Álvarez, C. (2025). La bacteria Desulfovibrio en el microbioma intestinal: ¿Un factor de riesgo para la Enfermedad de Parkinson? Quimiofilia, 2025, 4, (2), 29-31.
MDPI y JACS: Franco-Rodríguez, N*.; Millares-Jasso, R.; Guillen-Bonilla, J.; Cavazos-Garduño, A.; Serrano-Niño, J.; Cortez-Álvarez, C. Quimiofilia, 2025, 4, 2, 29-31.
DOI: https://doi.org/10.56604/qflaSC2025422931
Recibido: 17 de septiembre 2025. Aceptado: 22 de octubre 2025. Publicado. 7 de diciembre de 2025.
www.quimiofilia.com. ISSN: 2683-2364. Registro IMPI: 2052060 QUIMIOFILIA.Reserva de derechos al uso exclusivo 2022: 04-2019-062013201300-203.
Introducción
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo crónico y progresivo caracterizado por la pérdida selectiva de neuronas dopaminérgicas en la sustancia negra del mesencéfalo y la acumulación de la proteína α-sinucleína en cuerpos de Lewy en el citoplasma neuronal, considerados marcadores neuropatológicos de la enfermedad.1 Clínicamente se manifiesta con síntomas motores como temblor rítmico involuntario, rigidez, bradicinesia y pérdida de expresión facial, mientras que los síntomas no motores comprenden depresión, trastornos del sueño y disfunción autonómica, lo que afecta significativamente la calidad de vida.1 La EP predomina en hombres y suele aparecer entre los 65 y 70 años, aunque también existen formas de inicio temprano.1
Históricamente, la EP ha sido considerada de origen neurológico; sin embargo, estudios recientes identificaron bacterias del género Desulfovibrio en todos los pacientes con EP analizados, observándose además una correlación entre la abundancia de este género y la severidad de los síntomas.2,3
La bacteria Desulfovibrio
Desulfovibrio spp. son bacterias Gram negativas, reductoras de sulfato, presentes en la microbiota intestinal humana.4 Se ha observado que su abundancia aumenta significativamente en pacientes con EP en comparación con individuos sanos, sugiriendo un papel en la patogénesis de la enfermedad.3 Estudios en modelos de Caenorhabditis elegans han demostrado que Desulfovibrio puede potenciar la agregación de α-sinucleína, fortaleciendo la hipótesis de un vínculo causal.5
Asociación entre Desulfovibrio y Parkinson
Niveles elevados de Desulfovibrio se correlacionan con la severidad clínica de la EP, incluyendo síntomas motores y no motores.2,3 Estos hallazgos han sido documentados tanto en análisis de la microbiota fecal de pacientes con la EP como en modelos experimentales con C. elegans.2,3,5 Además, la presencia de estas bacterias se asocia con otros biomarcadores intestinales y sistémicos, como lipopolisacáridos y nanopartículas de magnetita, que contribuyen a la inflamación y estrés oxidativo.6,7
En este sentido, la asociación observada en estudios en humanos y modelos animales refuerza la hipótesis de que la alteración del microbioma intestinal, y en particular la expansión de cepas de Desulfovibrio, podría actuar como un factor desencadenante temprano en la neurodegeneración característica de la EP.
Metabolitos bacterianos y patogénesis
Desulfovibrio produce metabolitos neurotóxicos, entre ellos el sulfuro de hidrógeno (H₂S), los lipopolisacáridos (LPS) y las nanopartículas de magnetita.2,6,7 Uno de los metabolitos identificado como posible agente causal es el H₂S, el cual puede inducir estrés oxidativo en neuronas dopaminérgicas y promover la agregación de α-sinucleína.7 LPS y otros productos bacterianos inducen inflamación intestinal crónica y activan células inmunitarias, generando un estado proinflamatorio que se propaga al sistema nervioso central.6,8,9
La exposición sostenida a estos metabolitos puede desencadenar una cascada de eventos que culmina en neurodegeneración, subrayando la importancia de la microbiota intestinal como factor modulador de la EP.10
Eje microbiota-intestino-cerebro y progresión de la EP
El eje microbiota-intestino-cerebro es un mecanismo clave mediante el cual las alteraciones intestinales afectan al sistema nervioso central.9 La disbiosis intestinal puede favorecer la progresión de la EP a través de metabolitos bacterianos tóxicos, la activación microglial y la neuroinflamación.8,10 Estudios sugieren que la inflamación intestinal crónica mediada por bacterias como Desulfovibrio puede favorecer la propagación de α-sinucleína desde el intestino hacia el cerebro a través del nervio vago, lo que indica un papel directo en la patogénesis de la enfermedad.10,11,12 En conjunto, estas evidencias apoyan un modelo integrador del eje microbiota–intestino–cerebro en la EP (ver Figura 1).
Perspectivas clínicas y terapéuticas
Estos estudios sientan las bases para considerar el análisis del microbioma intestinal como un biomarcador temprano en la identificación de individuos en riesgo de desarrollar la enfermedad de Parkinson, así como para la estratificación de pacientes.2,3,7
A su vez, abren oportunidades terapéuticas orientadas a la modulación de la microbiota mediante probióticos, prebióticos, intervenciones dietéticas o estrategias farmacológicas que reduzcan la abundancia de bacterias patógenas oportunistas como Desulfovibrio.9,13,14 Este conocimiento representa un parteaguas en la comprensión de la relación causal entre Desulfovibrio y la EP,2,3,7 y plantea la posibilidad de diseñar estrategias preventivas que limiten la neuroinflamación y la producción de metabolitos neurotóxicos, contribuyendo así a ralentizar la progresión de la enfermedad.
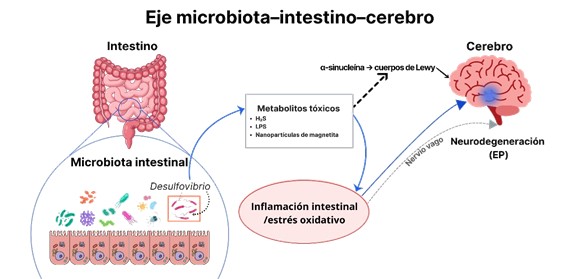
Figura 1. Representación esquemática del eje microbiota–intestino–cerebro y el papel de Desulfovibrio en la EP: producción de H₂S, LPS y nanopartículas de magnetita; inflamación intestinal (ruta sistémica) y posible transmisión por nervio vago (ruta neural); agregación de α-sinucleína y formación de cuerpos de Lewy.
Descargue aquí el artículo en PDF
- Simon, D.; Tanner, C.; Brundin, P. Parkinson Disease Epidemiology, Pathology, Genetics, and Pathophysiology. Clin. Geriatr. Med. 2020, 36 (1), 1–12. https://doi.org/10.1016/j.cger.2019.08.002 ↩︎
- Murros, K. E.; Huynh, V. A.; Takala, T. M.; Saris, P. E. J. Desulfovibrio Bacteria Are Associated With Parkinson’s Disease. Front. Cell. Infect. Microbiol. 2021, 11, 652617. https://doi.org/10.3389/fcimb.2021.652617. ↩︎
- Nie, S.; Jing, Z.; Wang, J.; Deng, Y.; Zhang, Y.; Ye, Z.; Ge, Y. The Link Between Increased Desulfovibrio and Disease Severity in Parkinson’s Disease. Appl. Microbiol. Biotechnol. 2023, 107, 3033–3045. https://doi.org/10.1007/s00253-023-12489-1 ↩︎
- Goldstein, E. J. C.; Citron, D. M.; Peraino, V. A.; Cross, S. A. Desulfovibrio desulfuricans Bacteremia and Review of Human Desulfovibrio Infections. J. Clin. Microbiol. 2003, 41 (6), 2752–2754. https://doi.org/10.1128/jcm.41.6.2752-2754.2003 ↩︎
- Huynh, V. A.; Takala, T. M.; Murros, K. E.; Diwedi, B.; Saris, P. E. J. Desulfovibrio Bacteria Enhance Alpha-Synuclein Aggregation in a Caenorhabditis elegans Model of Parkinson’s Disease. Front. Cell. Infect. Microbiol. 2023, 13, 1181315. https://doi.org/10.3389/fcimb.2023.1181315. ↩︎
- Shandilya, S.; Kumar, S.; Jha, N. K.; Kesari, K. K.; Ruokolainen, J. Interplay of Gut Microbiota and Oxidative Stress: Perspective on Neurodegeneration and Neuroprotection. J. Adv. Res. 2021, 28, 1–17. https://doi.org/10.1016/j.jare.2021.02.001. ↩︎
- Murros, K. E. Hydrogen Sulfide Produced by Gut Bacteria May Induce Parkinson’s Disease. Cells 2022, 11, 978. https://doi.org/10.3390/cells11060978 ↩︎
- Cavaliere, G.; Traina, G. Neuroinflammation in the Brain and Role of Intestinal Microbiota: An Overview of the Players. J. Integr. Neurosci. 2023, 22, 1–13. https://doi.org/10.31083/j.jin2201001 ↩︎
- Elfil, M.; Kamel, S.; Kandil, M. M.; Koo, B. B.; Schaefer, S. Implications of the Gut Microbiome in Parkinson’s Disease. Mov. Disord. 2020, 35, 921–933. https://doi.org/10.1002/mds.28004 ↩︎
- Kalyanaraman, B.; Cheng, G.; Hardy, M. Gut Microbiome, Short-Chain Fatty Acids, Alpha-Synuclein, Neuroinflammation, and ROS/RNS: Relevance to Parkinson’s Disease and Therapeutic Implications. Redox Biol. 2024, 45, 102080. https://doi.org/10.1016/j.redox.2021.102080 ↩︎
- Marć, M. A.; Jastrząb, R.; Mytych, J. Does the Gut Microbial Metabolome Really Matter? The Connection Between Gut Metabolome and Neurological Disorders. Nutrients 2022, 14, 978. https://doi.org/10.3390/nu14050978. ↩︎
- Fabi, J. P. The Connection Between Gut Microbiota and Its Metabolites with Neurodegenerative Diseases in Humans. Metab. Brain Dis. 2024, 39, 1–14. https://doi.org/10.1007/s11011-023-01013-3 ↩︎
- Li, Q.; Meng, L.-B.; Chen, L.-J.; Shi, X.-H.; Tu, L.; Zhou, Q.; Yu, J.-L.; Liao, X.; Zeng, Y.; Yuan, Q.-Y. The Role of the Microbiota-Gut-Brain Axis and Intestinal Microbiome Dysregulation in Parkinson’s Disease. Front. Neurol. 2023, 14, 37305758. https://doi.org/10.3389/fnins.2023.1105657. ↩︎
- Hirayama, M.; Ohno, K. Parkinson’s Disease and Gut Microbiota. Ann. Nutr. Metab.2021, 77, 28–35. https://doi.org/10.1159/000518147. ↩︎
