Quimiofilia, 2022, 1, 2, 12-16
Jesús Guadalupe Pérez-Flores,1,2 Laura García-Curiel,2 Emmanuel Pérez-Escalante,1 Rita Paz-Samaniego,3 Elizabeth Contreras-López,1 y Aldahir Alberto Hernández-Hernández.4Jesús Guadalupe Pérez-Flores,1,2 Laura García-Curiel,2 Emmanuel Pérez-Escalante,1 Rita Paz-Samaniego,3 Elizabeth Contreras-López,1 y Aldahir Alberto Hernández-Hernández.4
- Área Académica de Química, Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo, Carretera Pachuca-Tulancingo km 4.5, 42184 Mineral de la Reforma, Hidalgo, México. jesus_perez@uaeh.edu.mx
- Área Académica de Enfermería, Instituto de Ciencias de la Salud, Universidad Autónoma del Estado de Hidalgo, Circuito Ex Hacienda La Concepción s/n, Carretera Pachuca-Actopan, 42060 San Agustín Tlaxiaca, Hidalgo, México.
- Departamento de Ciencias Químico Biológicas, Universidad de Sonora. Blvd. Luis Encinas J., Calle Av. Rosales s/n, Col. Centro, 83000 Hermosillo, Sonora, México.
- Área Académica de Ingeniera Agroindustrial e Ingeniería en Alimentos, Instituto de Ciencias Agropecuarias, Universidad Autónoma del Estado de Hidalgo, Avenida Universidad Km. 1 s/n Exhacienda Aquetzalpa, 43600 Tulancingo de Bravo, Hidalgo, México.
Cite este artículo así:
APA: Pérez-Flores, J. García-Curiel, L. Pérez-Escalante, E. Paz-Samaniego, R. Contreas-López E. Hernández-Hernández, A. (2022). Integración de subproductos agroalimentarios dentro de una economía circular: el caso de los arabinoxilanos obtenidos de subproductos del procesamiento de cereales Quimiofilia, 1, (2) 12-16.
DOI: https://doi.org/10.56604/qfla2022121216
ACS: Pérez-Flores, J.; García-Curiel, L.; Pérez-Escalante, E.; Paz-Samaniego, R.; Contreas-López E.; Hernández-Hernández, A.. Quimiofilia, 2022, 1, 2, 1-16.
DOI: https://doi.org/10.56604/qfla2022121216
Recibido: septiembre 29, 2022
Aceptado: noviembre 10, 2022
Publicado: noviembre 30, 2022
ISSN: 2683-2364
Registro IMPI: 2052060 QUIMIOFILIA
Reserva de derechos al uso exclusivo 2022:
04-2019-062013201300-203
Resumen
La biomasa vegetal procedente de diversos procesos agroalimentarios puede producir efectos adversos en el ambiente debido a su mala disposición y por la falta de estrategias para su aprovechamiento. Por ello, es necesario buscar alternativas para incorporar estos subproductos dentro de una economía circular. En este trabajo se desarrolla un panorama general de la extracción de arabinoxilanos (AX), centrándose en la estrategia universal de recuperación de compuestos bioactivos. El método y fuente de extracción de AX definirá sus propiedades funcionales y sus aplicaciones en diferentes áreas. La recuperación de materiales de subproductos agroalimentarios puede favorecer el medio ambiente y la economía.
Palabras Clave
Arabinoxilanos; extracción; subproductos agroalimentarios; estrategia universal; economía circular.
Los subproductos y los residuos agroalimentarios generados en las diferentes etapas de los procesos productivos pueden impactar negativamente en el medio ambiente debido a la falta de aprovechamiento o por su mala disposición. Por ejemplo, en la industria del procesamiento de cereales y de frutas no se suelen utilizar por completo algunas materias primas como cáscaras, semillas, salvado, bagazo, etc.; siendo consideradas como un subproducto, generándose grandes cantidades que no están siendo aprovechadas. Estos subproductos pueden ser una fuente potencial de compuestos bioactivos, tales como antioxidantes y biopolímeros, siendo una materia prima de bajo costo.[1],[2],[3]
Por lo anterior, en las últimas décadas se ha observado un creciente interés por incorporar estos subproductos dentro de una economía circular (EC) para la obtención de materiales biológicos sostenibles. En sentido estricto, una EC transforma de forma radical los sistemas de producción y consumo, pues la creación de valor ya no depende únicamente del uso de recursos. De esta forma, las materias primas se reducen, se optimizan los recursos, y los residuos y subproductos se reutilizan, reciclan y/o recuperan.[4]
En este sentido, la recuperación de compuestos bioactivos a partir de subproductos agroalimentarios puede ser llevada a cabo mediante una metodología conocida como “Estrategia universal de recuperación” que será descrita más adelante. Un ejemplo de este tipo de subproductos lo constituye la biomasa lignocelulósica procedente del procesamiento de cereales, de la producción de cerveza o de la agricultura (restos de maíz, bagazo de caña de azúcar, paja, etc.), la cual contiene biopolímeros como celulosa, hemicelulosas y lignina; en concentraciones de 38-50%, 23-32% y 15-25% (p/p), respectivamente.[5],[6]. De estos, las hemicelulosas son el segundo componente mayoritario de la biomasa y dentro de estas, los xilanos son los más abundantes.6,[7] Los xilanos son un grupo
Clasificación de los arabinoxilanos
Los AX se clasifican, según su capacidad para disolverse en agua en arabinoxilanos extraíbles en agua (WEAX) y en no extraíbles en agua (WUAX). La diferencia en la solubilidad puede estar influenciada por los patrones de sustitución, la MW, el grado de entrecruzamiento, enlaces covalentes entre los grupos hidroxilo de los AX y los grupos carboxilo de ácidos urónicos y por la formación de puentes de AF entre cadenas de AX adyacentes.9,16
Los WEAX se localizan ligeramente unidos a la superficie de la pared celular, donde la presencia de cadenas laterales de arabinosa, de glucosa y de galactosa, puede evitar la interacción entre cadenas de AX, incrementando su solubilidad y por tanto su extractabilidad en agua.[1] Por otro lado, los WUAX, se encuentran enlazados a través de puentes de hidrógeno y enlaces covalentes, a componentes de la matriz celular, tales como proteínas y lignina9. En cereales y sus subproductos, el contenido de WUAX es mucho mayor que el de WEAX, por lo que son una potencial fuente de extracción de AX.[2]
diverso de polisacáridos que poseen una cadena principal constituida de unidades de xilosa que, de acuerdo a su fuente y método de extracción, puede unirse a diferentes grupos funcionales,[1] originando características estructurales particulares6. Por su potencial de aplicación en la industria, este trabajo se centra en la extracción de arabinoxilanos (AX), que, de acuerdo con sus características estructurales, pueden presentar múltiples aplicaciones tecnológicas, ecológicas y/o económicas en la industria alimentaria, biomédica y cosmética.[2]
De esta forma, el presente trabajo proporciona un panorama general de la extracción de los AX, centrándose en la estrategia universal de recuperación de compuestos bioactivos, con la finalidad de difundir esta línea de investigación que representa una alternativa viable para la incorporación de estos subproductos dentro de una EC.
Arabinoxilanos
Los AX son polisacáridos heterogéneos no amiláceos localizados en diversos tejidos de los granos de cereales como son las paredes celulares del endospermo, de la capa de aleurona y del pericarpio.[3] También se ha reportado su extracción a partir de otros materiales lignocelulósicos como el bagazo de caña,[4] de la cáscara de plátano,[5] o del bagazo de zanahoria.[6]
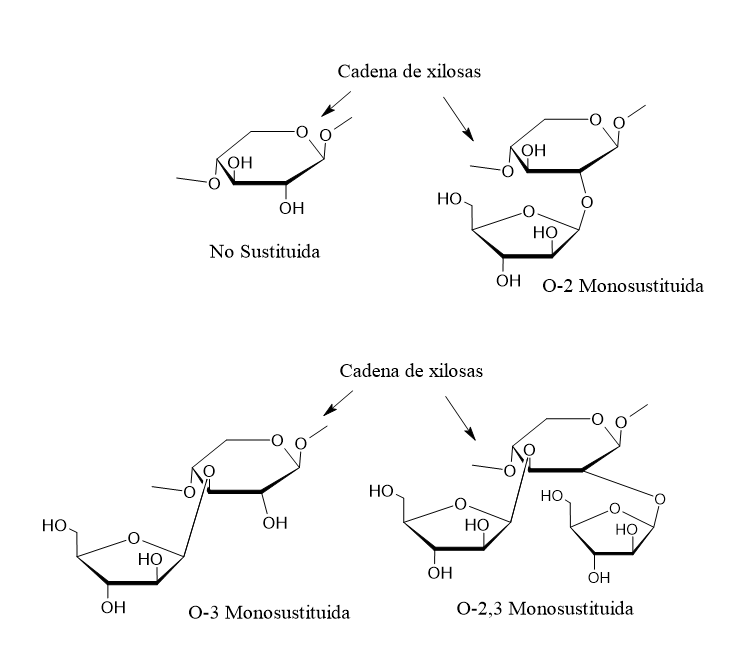
La estructura química de los AX consiste en una cadena principal de xilosas unidas a otras cadenas de arabinosa y que pueden estar o no sustituidas (Figura 1). La cantidad de unidades de arabinosa y el grado de sustitución suelen afectar considerablemente las propiedades fisicoquímicas de los AX, por lo que las propiedades de
los AX dependen de su composición y de sus características estructurales.9,[1],[2] También pueden encontrarse otros azúcares como galactosa, xilosa y ácido glucorónico.14 La presencia de ciertos azúcares en la estructura de los AX permite la ramificación a partir de la cadena principal, lo cual está relacionado con el carácter hidrofílico y la solubilidad del polisacárido.[3]
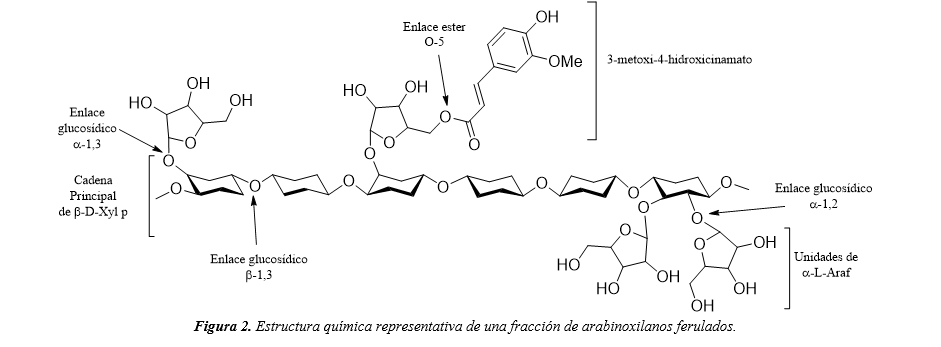
Los AX también pueden presentar en su estructura la presencia de ácidos fenólicos, tales como el ácido ferúlico (AF) y el ácido p-cumárico. Estos ácidos suelen estar unidos a residuos de arabinosa mediante enlaces éster (Figura 2).9 La presencia del AF influye sobre las propiedades fisicoquímicas de los AX, ya que la unión mediante un enlace covalente de al menos dos unidades de AF, genera el entrecruzamiento de las cadenas de AX, aumentando la viscosidad de la solución y favoreciendo la formación de hidrogeles.14,16,[4]
Los AX poseen propiedades que les permiten ser utilizados en la industria alimentaria, cosmética y biomédica,17 las cuales dependen de ciertas características del polisacárido, entre las que se encuentran la masa molar (MW), la relación arabinosa/xilosa (A/X) y el perfil de ácidos hidroxicinámicos (HCA). Estas particularidades dependerán de la fuente y del método de extracción.
Extracción de AX mediante la estrategia universal de recuperación
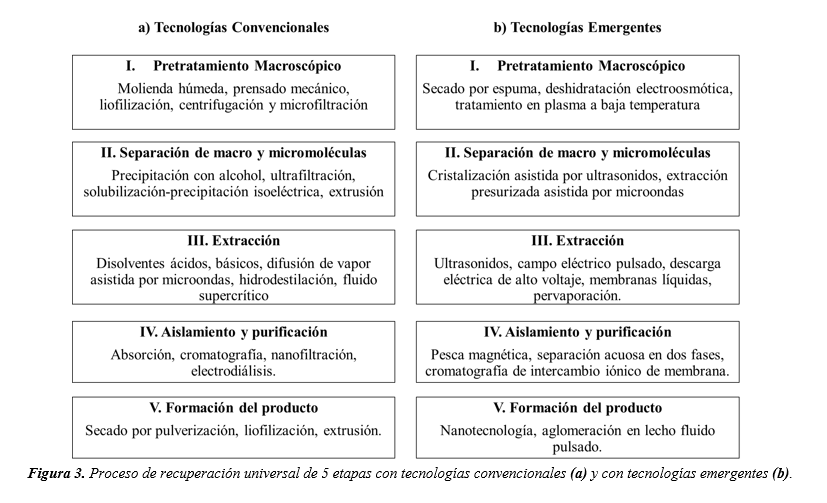
La estrategia universal de recuperación de compuestos bioactivos a partir de subproductos agroalimentarios es una metodología que consta de 5 etapas como se muestra en la Figura 3. Este procedimiento se lleva a cabo realizando la separación desde el nivel macroscópico al macromolecular y luego al nivel micromolecular; para posteriormente aplicar un paso de clarificación o aislamiento y, finalmente, la formación del producto o la encapsulación de los compuestos objetivo. Debido a que los que los subproductos son mezclas constituidas de diferentes fases macroscópicas conformadas por diferentes moléculas con diferentes propiedades estructurales y fisicoquímicas, esta estrategia universal permite separar y aislar gradualmente los compuestos objetivo, garantizando la recuperación de varios tipos de compuestos valiosos a partir de cualquier subproducto mediante la gestión optimizada de las tecnologías disponibles.[3]
Los pasos para realizar la extracción de AX a partir de subproductos agroalimentarios mediante la implementación de la estrategia universal de recuperación son los siguientes:
- Pretratamiento de la muestra: consiste en retirar los compuestos que puedan interferir con los AX, como la remoción de humedad por secado en estufa a 60°C o por liofilización y la reducción de tamaño por pulverización o fraccionamiento por tamizado logrando tamaños de 30 a 60 µm.9,[1]
- Separación de macro y micromoléculas: se ha reportado la eliminación de ceras y de otros compuestos hidrofóbicos mediante una maceración con etanol, la hidrólisis enzimática del almidón mediante tratamiento térmico, la eliminación de las maltodextrinas con lavados de agua destilada o el desalmidonado y la desproteinización por tratamientos enzimáticos. Para la eliminación de minerales se utiliza el ácido etilendiaminotetraacético (EDTA).9,[1],[2]
- Extracción: se ha reportado el uso de métodos alcalinos, con ácidos y con enzimas. En la extracción alcalina se genera el hinchamiento de la celulosa, lo que aumenta la solubilidad de los AX y se afecta la estructura nativa del polímero. Este tratamiento se realiza con álcalis fuertes como NaOH, KOH, Ba(OH)₂ y Ca(OH)₂.9,19,[3] La extracción ácida de WUAX puede realizarse con ácidos fuertes como el HCl.[4] En la extracción enzimática se han utilizado endo-β-(1,4)-xilanasas (EC 3.2.1.8, xilanasas) que hidrolizan la cadena principal y reducen el peso molecular del polisacárido.24,[5]
- Aislamiento y purificación: Los AX pueden aislarse utilizando precipitación por acidificación, con etanol, fraccionamiento de membrana, por cromatografía de exclusión por tamaño o por cromatografía de intercambio iónico. Posteriormente, para la purificación destacan los métodos de extracción enzimática con α-amilasa y proteasa y una posterior diálisis pata eliminar especies con MW < 12 kDa.[6],[7],[8]
- Obtención del producto: Para la obtención de AX en polvo se necesita eliminar agua por secado a vacío a 50°C, por liofilización o por aspersión.9
En general, el proceso de extracción de los AX define sus características estructurales, composición química, propiedades fisicoquímicas y sus aplicaciones, por lo que es necesario conocer las técnicas de extracción y aislamiento. Para ello, en ocasiones es necesario llevar a cabo la optimización del proceso de extracción de manera que permita obtener las características deseadas respecto a rendimiento, relación A/X, masa molar y perfil de ácidos hidroxicinámicos, para la aplicación tecnológica requerida. De hecho, ya ha sido reportada la optimización de la extracción a partir de pericarpio de trigo.[9],[10]
Conclusiones
En este trabajo se realizó una revisión general de los métodos de extracción de AX de subproductos agroindustriales basándose en la estrategia universal de recuperación de compuestos bioactivos. En esta estrategia se utilizan técnicas de extracción convencionales o emergentes, que dependerán de la matriz y de la relación costo-beneficio. La extracción de AX puede realizarse con álcalis, ácidos y enzimas. La elección del método de extracción definirá las características químicas y propiedades funcionales de los AX, lo cual permitirá mejorar el aprovechamiento, la posible aplicación en la industria y la incorporación dentro de una EC.
[1]. Bosmans, T.J.; Stépán, A.M.; Toriz, G.; Renneckar, S.; Karabulut, E.; Wågberg, L. et al. Assembly of debranched xylan from solution and on nanocellulosic surfaces. Biomacromolecules. 2014, 15, 924-930. https://doi.org/10.1021/bm4017868
[2]. Radenkovs, V.; Juhnevica-Radenkova, K.; Górnaś, P.; Seglina, D. Non-waste technology through the enzymatic hydrolysis of agro-industrial by-products. Trends Food Sci. Technol. 2018, 1, 64-76. https://doi.org/10.1016/j.tifs.2018.05.013
[3]. Peng, X.; Nie, S.; Li, X.; Huang, X.; Li, Q. Characteristics of the water- And alkali-soluble hemicelluloses fractionated by sequential acidification and graded-ethanol from sweet maize stems. Molecules. 2019, 24, 212-220. https://doi.org/10.3390/molecules24010212
[4]. Camacho-Otero, J.; Boks, C.; Pettersen, I.N.; Consumption in the circular economy: A literature review. Sustain. 2018, 10, 2758-2782. https://doi.org/10.3390/su10082758
[5]. Singh, J.; Vyas, P.; Dubey, A.; Upadhyaya, C.; Kothari, R.; Tyagi, V. Kumar, A. Assessment of different pretreatment technologies for efficient bioconversion of lignocellulose to ethanol. Front. Biosci. – Sch. 2018, 10, 350-371. DOI: 10.2741/S521
[6]. Naidu, D.; Hlangothi, S.; John, M.. Bio-based products from xylan: A review. Carbohydr. Polym. 2018, 179, 28-41. https://doi.org/10.1016/j.carbpol.2017.09.064
[7]. Limayem, A.; Ricke, S. Lignocellulosic biomass for bioethanol production: Current perspectives, potential issues and future prospects. Prog. Energy Combust. Sci. 2012, 38, 449-67. https://doi.org/10.1016/j.pecs.2012.03.002
[8]. Cantu-Jungles, T.; Iacomini, M.; Cipriani, T.; Cordeiro, L. Isolation and characterization of a xylan with industrial and biomedical applications from edible açaí berries (Euterpe oleraceae). Food Chem. 2017, 221, 1595-1597. DOI: 10.1016/j.foodchem.2016.10.133
[9]. Pérez-Flores, J.; Contreras-López, E.; Castañeda-Ovando, A.; Pérez-Moreno, F.; Aguilar-Arteaga, K.; Álvarez-Romero, G. Téllez-Jurado, A. Physicochemical characterization of an arabinoxylan-rich fraction from brewers’ spent grain and its application as a release matrix for caffeine. Food Res. Int. 2019, 116, 1020-1030. https://doi.org/10.1016/j.foodres.2018.09.041
[10]. Rosicka-Kaczmarek, J.; Komisarczyk A.; Nebesny E.; Makowski B. The influence of arabinoxylans on the quality of grain industry products. Eur. Food Res. Technol. 2016, 242, 295-303. https://doi.org/10.1007/s00217-015-2549-0
[11]. Khaleghipour, L.; Linares-Pastén, J.A.; Rashedi, H.; Ranaei Siadat, S.O.; Jasilionis, A.; Al-Hamimi, S., Sardari, R.; Nordberg-Karlsson, E. Extraction of sugarcane bagasse arabinoxylan, integrated with enzymatic production of xylo-oligosaccharides and separation of cellulose. Biotechnol. Biofuels. 2021, 14, 1-19. https://doi.org/10.1186/s13068-021-01993-z
[12]. Zhang, P.; Wampler, J.; Bhunia, A.K.; Burkholder, K.; Patterson, J.; Whistler, R. Effects of arabinoxylans on activation of murine macrophages and growth performance of broiler chicks. Cereal. Chem. 2004, 81, 511-514. https://doi.org/10.1094/CCHEM.2004.81.4.511
[13]. Yadav, M.; Kale, M.; Hicks, K.; Hanah, K. Isolation, characterization and the functional properties of cellulosic arabinoxylan fiber isolated from agricultural processing by-products, agricultural residues and energy crops. Food Hydrocoll. 2017, 63, 545-551. https://doi.org/10.1016/j.foodhyd.2016.09.022
[14]. Mendez-Encinas, M.; Carvajal-Millan, E.; Rascon-Chu, A.; Astiazaran-Garcia, H.; Valencia-Rivera, D. Ferulated Arabinoxylans and Their Gels: Functional Properties and Potential Application as Antioxidant and Anticancer Agent. Oxid. Med. Cell. Longev. 2018, 2314759. https://doi.org/10.1155/2018/2314759
[15]. Mendez-Encinas, M.; Carvajal-Millan, E.; Rascón-Chu, A.; Astiazarán-García, H.; Valencia-Rivera, D.; Brown-Bojorquez, F.; Alday, E.; Velazquez, C. Arabinoxylan-based particles: In vitro antioxidant capacity and cytotoxicity on a human colon cell line. Med. 2019, 55, 349. doi: 10.3390/medicina55070349
[16] Morales-Ortega, A.; Niño-Medina, G.; Carvajal-Millán, E.; Gardea-Béjar, A.; Torres-Chávez, P.; López-Franco, Y.; Rascón-Chu, A.; Lizardi-Mendoza, J. Los arabinoxilanos ferulados de cereales. Una revisión de sus características fisicoquímicas y capacidad gelificante. Rev. Fitotec. Mex. 2013, 36, 439-446.
[17]. Paz-Samaniego, R.; Rascón-Chu, A.; Brown-Bojorquez, F.; Carvajal-Millan, E.; Pedroza-Montero, M.; Silva-Campa, E.; Sotelo-Cruz, N.; López-Franco, y.; Lizardi-Mendoza, J. Electrospray-assisted fabrication of core-shell arabinoxylan gel particles for insulin and probiotics entrapment. J. Appl. Polym. Sci. 2018, 135 (26), 46411. https://doi.org/10.1002/app.46411
[18]. Rao, R.S.P.; Muralikrishna, G. Water soluble feruloyl arabinoxylans from rice and ragi: Changes upon malting and their consequence on antioxidant activity. Phytochemistry. 2006, 67, 91-99. DOI: 10.1016/j.phytochem.2005.09.036
[19]. Zhang, Z.; Smith, C.; Li, W. Extraction and modification technology of arabinoxylans from cereal by-products: A critical review. Food. Res. Int. 2014, 65, 423-436. https://doi.org/10.1016/j.foodres.2014.05.068
[20]. Galanakis CM. The universal recovery strategy. Food Waste Recovery: Processing Technologies and Industrial Techniques, 2nd de.; Academic Press: London, United Kingdom, 2015, 51-65.
[21]. Stoklosa, R.; Latona, R.; Bonnaillie, L.; Yadav, M. Evaluation of arabinoxylan isolated from sorghum bran, biomass, and bagasse for film formation. Carbohydr. Polym. 2019, 213, 382-392. https://doi.org/10.1016/j.carbpol.2019.03.018
[22]. Arai, T.; Biely. P.; Uhliariková, I.; Sato, N.; Makishima, S.; Mizuno, M.; Nozaki, K.; Kaneko. S.; Amano, Y. Structural characterization of hemicellulose released from corn cob in continuous flow type hydrothermal reactor. J. Biosci. Bioeng. 2019, 127, 222-230. https://doi.org/10.1016/j.jbiosc.2018.07.016
[23]. Escarnot, E.; Aguedo, M.; Agneessens, R.; Wathelet, B.; Paquot, M. Extraction and characterization of water-extractable and water-unextractable arabinoxylans from spelt bran: Study of the hydrolysis conditions for monosaccharides analysis. J. Cereal Sci. 2011, 53, 45-52. https://doi.org/10.1016/j.jcs.2010.09.002
[24]. Bender, D.; Nemeth, R.; Wimmer, M.; Götschhofer, S.; Biolchi, M.; Török. K.; Tömösközi, S.; D’Amico, S.; Schoenlechner, R. Optimization of Arabinoxylan Isolation from Rye Bran by Adapting Extraction Solvent and Use of Enzymes. J. Food Sci. 2017; 82, 2562-2568. doi: 10.1111/1750-3841.13920
[25]. Zhou, S.; Liu, X.; Guo, Y.; Wang. Q.; Peng, D.; Cao, L. Comparison of the immunological activities of arabinoxylans from wheat bran with alkali and xylanase-aided extraction. Carbohydr. Polym. 2010, 81, 784-789. https://doi.org/10.1016/j.carbpol.2010.03.040
[26]. Van Craeyveld, V.; Holopainen, U.; Selinheimo, E.; Poutanen, K.; Delcour. J.; Courtin, C. Extensive dry ball milling of wheat and rye bran leads to in situ production of arabinoxylan oligosaccharides through nanoscale fragmentation. J. Agric. Food Chem. 2009, 57, 8467-8473. https://doi.org/10.1021/jf901870r
[27]. Anderson, C.; Simsek, S. A novel combination of methods for the extraction and purification of arabinoxylan from byproducts of the cereal industry. J. Food. Meas. Charact. 2019, 13, 1049-1057. https://doi.org/10.1007/s11694-018-00020-4
[28]. Peng, F.; Peng, P.; Xu, F.; Sun. R. Fractional purification and bioconversion of hemicelluloses. Biotechnology Advances. 2012, 30, 879-903. https://doi.org/10.1016/j.biotechadv.2012.01.018
[29]. Jacquemin, L.; Mogni, A.; Zeitoun, R.; Guinot, C.; Sablayrolles, C.; Saulnier, L.; Pontalier, P. Comparison of different twin-screw extraction conditions for the production of arabinoxylans. Carbohydr. Polym. 2015, 116, 86-94. https://doi.org/10.1016/j.carbpol.2014.06.071
[30]. Rudjito, R.C.; Ruthes, A.C.; Jiménez-Quero, A.; Vilaplana, F. Feruloylated arabinoxylans from wheat bran: Optimization of extraction process and validation at pilot scale. ACS Sustain Chem. Eng. 2019, 7, 13167-13177. https://doi.org/10.1021/acssuschemeng.9b02329
[31]. Wang, J.; Sun, B.; Liu, Y.; Zhang, H. Optimisation of ultrasound-assisted enzymatic extraction of arabinoxylan from wheat bran. Food Chem. 2014, 150, 482-488. https://doi.org/10.1016/j.foodchem.2013.10.121
