Quimiofilia, 2022, 1, 2, 22-25
Irving David Pérez Landa,1 Felipe Barrera Méndez,2, 3 José Luis Olivares Romero.2
1 Tecnológico Nacional de México/Instituto Tecnológico de Boca del Río. Veracruz, México. irvingperez@bdelrio.tecnm.mx
2 Red de Estudios Moleculares Avanzados, Clúster Científico y Tecnológico BioMimic®, Instituto de Ecología A.C. Veracruz, México. olivares@inecol.mx
3 Investigador por México CONACYT en el Instituto de Ecología AC, Veracruz, México. felipe.barrera@inecol.mx
Cite este artículo así:
APA: Pérez-Landa, I. Barrera-Méndez, F. Olivares-Romero, J. (2022). Polímeros Biodegradables como Materiales de Encapsulación de Plaguicidas Quimiofilia, 1, (2) 22-25.
DOI: https://doi.org/10.56604/qfla2022122225
ACS: Pérez-Landa, I.; Barrera-Méndez, F.; Olivares-Romero, J.
Quimiofilia, 2022, 1, 2, 22-25
DOI: https://doi.org/10.56604/qfla2022122225
Recibido: Octubre 1, 2022
Aceptado: Noviembre 07, 2022
Publicado: Noviembre 30, 2022
ISSN: 2683-2364
Registro IMPI: 2052060 QUIMIOFILIA
Reserva de derechos al uso exclusivo 2022:
04-2019-062013201300-203.
Resumen
Los plaguicidas hechos por científicos han tenido una función importante en el control de plagas y el desarrollo agrícola. Sin embargo, su manejo indiscriminado ha generado numerosos problemas medioambientales. Dada la creciente demanda mundial de alimentos y la urgencia por desarrollar estrategias para el control de plagas, el uso de sistemas portadores de plaguicidas, desarrollados a partir de materiales biodegradables, a escala micro y nanométrica, proporciona una alternativa competente gracias a su capacidad de proteger a los ingredientes activos de su degradación y de liberarlos lentamente, reduciendo su aplicación frecuente.
Palabras Clave
Polímeros biodegradables; encapsulación; plaguicidas.
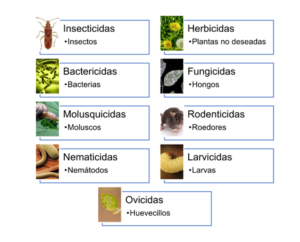
Los plaguicidas son agroquímicos que contribuyen a la eliminación de plagas y enfermedades de las plantas para aumentar la producción de cultivos. El consumo mundial de plaguicidas ha aumentado a aproximadamente dos millones de toneladas por año; del cual el 45% se usa solo en Europa, el 25% se consume en los Estados Unidos y el 25% en el resto del mundo.[1] Dado que estos se aplican en función de la infestación principal de un organismo específico, pueden clasificarse en función del organismo objetivo a eliminar (Figura 1). Asimismo, podemos clasificar a estas sustancias con respecto a su naturaleza química en: organofosforados, carbamatos, azoles, amidas, piretroides, organoclorados, microbianos, botánicos, neonicotinoides, entre otros (Tabla 1).2
Las formulaciones de plaguicidas tradicionales habitualmente se aplican de forma indiscriminada y directamente sobre el suelo o las plantas. Como consecuencia, en cada aplicación existe un gran desperdicio del plaguicida, el cual sufre pérdidas por arrastre de corrientes de aire, volatilización, lavados por agua de riego, y de la parte que logra mantenerse en las plantas o suelo, aún se sufrirán pérdidas por degradación de la molécula por temperatura, luz UV, acción microbiana, etc., finalmente llegando una pequeña fracción al organismo objetivo (cerca del 10% de la aplicación original).[1]3 Este desperdicio contribuye con la contaminación ambiental, la pérdida de biodiversidad del suelo, la fijación de nitrógeno, la bioacumulación de ingredientes activos, la aniquilación de organismos no objetivo (depredadores y polinizadores) y la destrucción de hábitats y fuentes de alimento de las aves, además de generar altos costos para los agricultores.[2]
Para reducir los impactos antes mencionados en el control de diversas plagas, es importante implementar técnicas actuales que involucren estrategias benignas con el ambiente y la salud pública. Para evitar las pérdidas excesivas y la exposición no deseada de los plaguicidas a otros organismos y el medio ambiente, se desean sistemas que los liberen de manera sostenida en un lugar adecuado y en un momento adecuado, y que la molécula activa permanezca protegida el resto del tiempo. La intensa investigación en el área de nanotecnología ha abierto una puerta a estos sistemas, entre los cuales se considera que la encapsulación de plaguicidas en polímeros es la más ventajosa.[1] En este sentido, el uso de partículas entre 1 y 100 nm de diámetro (escala nanométrica),a, [2], [3] y superiores (escala micrométrica),[4],[5] en la agricultura es altamente recomendable debido a que pueden producirse a partir de materiales
biodegradables y a que son capaces de liberar lentamente las moléculas funcionales que contienen (lo que conlleva a una reducción en la cantidad aplicada y número d aplicaciones) y poseen un tamaño pequeño, una gran capacidad de carga, una gran área superficial, estabilidad y solubilidad, en comparación con sus equivalentes voluminosos.[1]
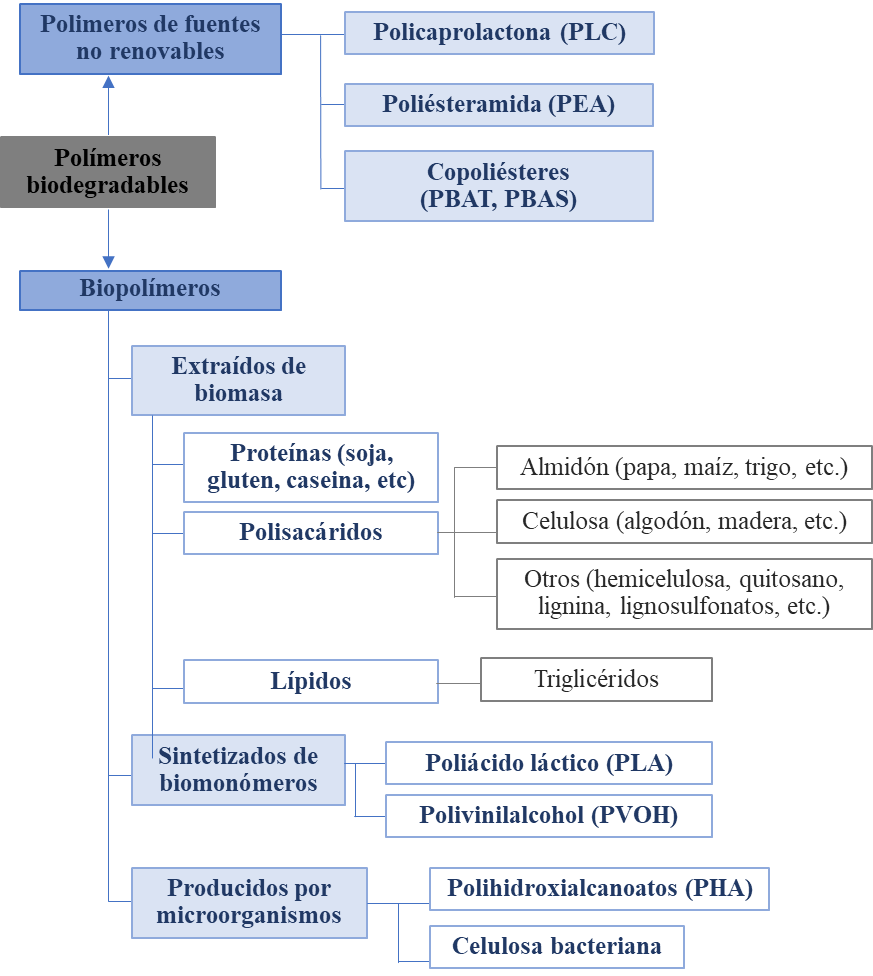
La encapsulación se puede definir como el proceso en el que se utiliza un recubrimiento o matriz (a base de polímeros, arcillas, lípidos o materiales inorgánicos porosos) para rodear o contener el ingrediente químico activo.[2] Las ventajas de la encapsulación son la protección contra entornos desfavorables, para una liberación controlada/sostenida y para una aplicación precisa. Algunas de las ventajas que ofrece el uso de polímeros para este propósito, es su biocompatibilidad, biodegradabilidad, fácil disponibilidad y, en algunos casos, su capacidad de protección contra la luz UV.[3] Se ha investigado la micro y nano encapsulación en varias matrices poliméricas, tanto biodegradables como no-biodegradables. Algunos ejemplos de polímeros sintéticos no-biodegradables, pero biocompatibles, son el polimetilmetacrilato, metacrilato de glicidilo, los poliepóxidos y los polímeros de acroleína. Dentro de los biodegradables encontramos a los láctidos y glicólidos (y sus copolímeros), cianocrilatos de polialquilo, polianhídridos, corbopol, y un enorme listado de polímeros naturales (proteínas y polisacáridos principalmente).[4] La Figura 2 muestra la clasificación de los polímeros biodegradables.[5]
Los polímeros biodegradables están ganando más popularidad y aprobación sobre los polímeros sintéticos no-biodegradables como materiales de encapsulación debido a su naturaleza ecológica, rentabilidad, fácil disponibilidad y biodegradabilidad.11 La Figura 3 presenta la clasificación de los polímeros biodegradables de acuerdo a su origen.[6] Dentro de los polímeros biodegradables, se encuentran los polímeros naturales, como los polisacáridos que han sido ampliamente utilizados por su nula toxicidad y biocompatibilidad, lo que los hace preferibles a los polímeros obtenidos de fuentes no renovables como el polietilenglicol y la policaprolactona (PCL), entre otros.5
Como ejemplos de polímeros naturales tenemos al quitosano, derivado de la quitana, la cual se encuentra en el exoesqueleto de los crustáceos y algunos insectos, aunque también se obtiene en gran medida a partir de hongos y bacterias, por lo cual se considera el amino polisacárido natural más abundante.7 En términos de disponibilidad, la quitina está al lado de la celulosa, disponible en una cantidad de más de 10 gigatoneladas al año.[1] Dentro de sus principales características se destacan su alta biocompatibilidad y biodegradabilidad, sus propiedades antimicrobianas, su capacidad para formar películas, su nula toxicidad, sus habilidades de adsorción, su bajo costo y su capacidad de mejorar la disolución de compuestos poco solubles en agua.7 Como aplicación del quitosano en sistemas nanoencapsulados, contamos, por ejemplo, con formulaciones que encapsulan rotenona y que, tras una liberación constante del pesticida, se aumentó la actividad insecticida contra hormigas rojas de fuego (Solenopsis invicta) mientras que, simultáneamente, se redujo el contenido alcaloide en su veneno, disminuyendo su capacidad de sobrevivencia en su medio ambiente por haber afectado a su capacidad predatoria y de ataque.6
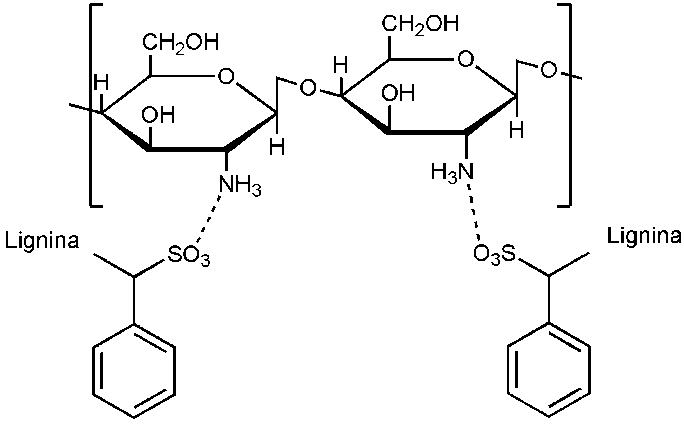
Los grupos amina del quitosano forman fácilmente complejos con una variedad de polímeros con carga opuesta, como el poli ácido acrílico, la carboximetilcelulosa, el xantano, el carragenano, el alginato, la pectina y los lignosulfonatos, entre otros;[1] el complejo formado por quitosano y lignosulfonato (Figura 4), también ha sido efectivo en la encapsulación de diversos plaguicidas que son susceptibles a foto degradarse gracias a la capacidad de absorción de luz UV del lignosulfonato.[2], [3] Los lignosulfonatos, son una clase de polisacáridos derivados de la lignina, los cuales son solubles en agua y su fuente de obtención principal es el licor de desecho de las fábricas de papel que procesan celulosa al sulfito para obtención de pulpa.[4] Como ejemplo de su aplicación, se han estudiado sistemas que utilizan lignina y lignosulfonatos para proteger a piretrinas de la fotodegradación y volatilización, logrando mantener la dosis tóxica 50% (DT50) hasta por 14 veces más tiempo que cuando se usa la molécula activa sin encapsular, y con eficiencias de encapsulación por encima del 77%.8 El uso de biopolímeros naturales de bajo costo como el quitosano y los lignosulfonatos, recuperados de los flujos laterales de procesos industriales, representan una solución innovadora y prometedora que también promueve la bioeconomía circular y los procesos respetuosos con el medio ambiente.
| Familia química | Plaguicidas representativos | |
| Organofosforados | Malatión, paratión, diazonin, diclorvos. | |
| Carbamatos | Aldicarb, carbofuran, propoxur, carbaril. | |
| Azoles | Propiconazol, procloraz, difenoconazol. | |
| Piretroides | Piretrina, cipermetrina, deltametrina. | |
| Organoclorados | Endosulfan, clordano, aldrin, lindano. | |
| Ureas | Diflobenzuron, novaluron, lufenuron. | |
| Microbianos | Spinosad, spinetoram, avermectina. | |
| Triazinas | Atrazina, simazina, propazina, cianazina. | |
| Anilidas | Propanil, carboxin, boscalid. | |
| Botánicos | Nicotina, rotenona, veratrina. | |
| Cetonas | Mesotriona, Imazetapir, tembotrione. | |
| Neonicotinoides | Dinotefuran, imidacloprid, clotianidin. | |

Conclusiones
Una de las alternativas para solucionar el asunto generado por el inadecuado uso de plaguicidas convencionales consiste en el uso de plaguicidas encapsulados en polímeros biodegradables. Cuando los plaguicidas son encapsulados pueden tener una liberación gradual que se traduce en una reducción en la frecuencia de aplicación, además, retrasan la pérdida de eficacia debido a la degradación y, para el caso de plaguicidas dirigidos a animales, pueden enmascarar el aroma de los ingredientes activos, facilitando su ingesta junto con una carnada. Esta tecnología es amigable con el ambiente, pero requiere constantes estudios de investigación tanto científicos, como tecnológicos. En particular, el empleo de tecnologías de encapsulación de plaguicidas mediante el uso de biopolímeros está estrechamente ligado al conocimiento de la compatibilidad de los materiales acarreadores, del método adecuado para llevar a cabo la encapsulación, a los resultados de pruebas de foto protección de las partículas obtenidas, a su capacidad de captura y al comportamiento de liberación del ingrediente activo, así como a la comprobación de su efectividad contra alguna plaga objetivo. A pesar de la creciente disponibilidad de materiales biodegradables de encapsulación, esta tecnología ha sido escasamente aprovechada en México.
[1]. Duhan, J.; Kumar, R.; Kumar, N.; Kaur, P.; Nehra, K; Duhan, S. Nanotechnology: the new perspective in precision agriculture. Biotechnol. Rep. 2017, 15,11–23. https://doi.org/10.1016/j.btre.2017.03.002
[2]. Athanassiou, C.; Kavallieratos, N.; Benelli, G.; Losic, D.; Usha Rani, P.; Desneux, N. Nanoparticles for pest control: current status and future perspectives. J. Pest Sci. 2018, 91,1–15. https://doi.org/10.1007/s10340-017-0898-0
[3]. Sinha, T.; Bhagwatwar, P.; Krishnamoorthy, C.; Chidambaram, R. Polymer based micro- and nanoencapsulation of agrochemicals. Polymers for agri-food Applications. 1st ed.; Springer Nature, Switzerland, 2019; 5–28.
[4]. Duhan, J.; Kumar, R.; Kumar, N.; Kaur, P.; Nehra, K.; Duhan, S. Nanotechnology: the new perspective in precision agriculture. Biotechnol. Rep. 2017, 15, 11–23. https://doi.org/10.1016/j.btre.2017.03.002|
a. 1 nm = 1×10-9 m = 0.000000001 m
[5]. Kumar, S.; Bhanjana, G.; Sharma, A.; Sidhu, M.C.; Dilbaghi N. Synthesis, characterization and on field evaluation of pesticide loaded sodium alginate nanoparticles. Carbohydr. Polym. 2014, 101:1061–1067. https://doi.org/10.1016/j.carbpol.2013.10.025
[6]. Zheng, Q.; Qin, D.; Wang, R.; Yan, W.; Zhao, W.; Shen, S.; Huang, S.; Cheng, D.; Zhao, C.; Zhang, Z. Novel application of biodegradable chitosan in agriculture: Using green nanopesticides to control Solenopsis invicta. Int. J. Biol. Macromol. 2022, 220:193-203. doi: 10.1016/j.ijbiomac.2022.08.066
[7]. Carlan, I.; Estevinho, B.; Rocha F. Study of microencapsulation and controlled release of modified chitosan microparticles containing vitamin B12. Powder Technol. 2017, 318:162–169. https://doi.org/10.1016/j.powtec.2017.05.041
[8]. Fernández-Pérez, M.; Flores-Céspedes, F.; Daza-Fernández, I.; Vidal-Peña, F.; Villafranca-Sánchez, M. Lignin and lignosulfonate-based formulations to protect pyrethrins against photodegradation and volatilization, Ind. Eng. Chem. Res. 2014, 53, 13557-13564. https://doi.org/10.1021/ie500186e
[9]. Chowdappa, P.; Shivakumar, G. Nanotechnology in crop protection: status and scope. Pest manage. hortic. ecsyst. 2013, 19:131-151.
[10]. Nuruzzaman, M.; Rahman, M.M.; Liu, Y.; Naidu, R. Nanoencapsulation, nano-guard for pesticides: A new window for safe application. J. Agric. Food Chem. 2016, 64:1447–1483. DOI: 10.1021/acs.jafc.5b05214
[11]. Campos, E.; de Oliveira, J.; Fraceto, L.; Singh B. Polysaccharides as safer release systems for agrochemicals. Agron. Sustain. Dev. 2014, 35:47–66. https://doi.org/10.1007/s13593-014-0263-0
[12]. Sampath Kumar, K.; Tejbe, S.; Banu, S.; Naga Lakshmi, P.; Bhowmik, D. Microencapsulation technology. IJRPB. 2013, 1:324–328.
[13]. De la Rosa Ramírez, H. Variación de las propiedades estructurales, térmicas y mecánicas del Poli (ácido láctico) por medio del empleo de aditivos derivados de la resina de pino. Máster Universitario, Procesado y Caracterización de Materiales, Universidad Politécnica de Valencia, Alcoy, España, septiembre de 2018.
[14]. Tomadoni, B.; Casalongué, C.; Alvarez, V.A. Biopolymer-based hydrogels for agriculture applications: swelling behavior and slow release of agrochemicals. Polymers for agri-food Applications. 1st ed.; Springer Nature, Switzerland, 2019; 99–125.
[15]. Perentena, L.; González, C; Celis, B.; Valbuena, A.; Colina, M. Síntesis de bases de Schiff derivadas del quitosano por reacción con p-dimetilaminobenzaldehído y 4-hidroxi-3-metoxibenzaldehído. Revista Iberoamericana de Polímeros. 2015, 16, 1-27.
[16]. Romero-Serrano, A.; Pereira, J. Estado del arte: Quitosano, un biomaterial versátil. Estado del Arte desde su obtención a sus múltiples aplicaciones. Revista INGENIERÍA UC. 2020, 27, 118-135.
[17]. Li, Y.; Zhou, M.; Pang, Y.; Qiu, X. Lignin-based microsphere: Preparation and performance on encapsulating the pesticide avermectin. ACS Sustain. Chem. Eng. 2017, 5:3321–3328. https://doi.org/10.1021/acssuschemeng.6b03180
[18]. Gao, F.; Yu, S.; Tao, Q.; Tan, W.; Duan L.; Li, Z.; Cui, H. Lignosulfonate improves photostability and bioactivity of abscisic acid under ultraviolet radiation. J. Agric. Food Chem. 2018, 66:6585–6593. https://doi.org/10.1021/acs.jafc.7b02002
[19]. Nguyen, M.; Hwang, I.; Park H. Enhanced photoprotection for photo-labile compounds using double-layer coated corn oil-nanoemulsions with chitosan and lignosulfonate. J. Photochem. Photobiol. B. 2013, 125:194–201. https://doi.org/10.1016/j.jphotobiol.2013.06.009
